
【题目】将生物质气(主要成分为CO、CO2和H2)甲烷化是改善燃气质量、改善燃气热值的有效手段之一。在催化剂的作用下,某密闭容器中,进行生物质气甲烷化时发生的主要反应为
①CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1;
CH4(g)+H2O(g) △H1;
②CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
CH4(g)+2H2O(g) △H2=-165.1kJ·mol-1;
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
CO2(g)+H2(g) △H3=-41.2kJ·mol-1。
请回答下列问题:
(1)△H1=___________,该反应在___________(填“高温”或“低温”)条件下能够自发进行。
(2)在合成气投料比保持恒定时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。α(CO)随温度升高而减小的原因是______________________。图中的压强由大到小的顺序为___________。

(3)温度为T1℃,在三个容积均为1L的恒容密闭容器中仅发生反应CO(g)+3H2(g)![]() CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。
CH4(g)+H2O(g),该反应中,正反应速率为v正=k正c(CO)c3(H2),逆反应速率为v逆=k逆c(CH4)·c(H2O),k正、k逆为速率常数,受温度影响。在第I个容器中,3min反应达到平衡时,CH4与CO的体积分数相同,则氢气的速率v(H2)=___________;下列说法正确的是___________(填序号)。

A.当温度改变为T2时,若k正=1.5k逆,则T2>T1
B.达平衡时,容器Ⅱ中H2的体积分数小于25%
C.达平衡时,容器Ⅲ与容器I中的总压强之比小于19︰20
D.达平衡时,容器Ⅱ中α(CO)大于容器I中α(CO)
(4)甲烷可作燃料电池的原料,若电解质为盐酸,当外电路转移16mol电子时(不考虑电子的损失),将负极产生的气体全部通入到2L1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序是______________________。
【答案】-206.3kJ·mol-1 低温 反应①与反应③皆为放热反应,温废升高,平衡向左移动,使得CO的转化率减小 P3>P2>P1 v(H2)=1mol·L-1·min-1 C c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
【解析】
第(1)问从盖斯定律和反应能否自发进行角度分析,第(2)、(3)问从温度、压强对化学平衡的影响分析,第(4)问注意水解程度:CO32->HCO3-,即可比较离子浓度大小。
(1)由盖斯定律,△H1=△H2+△H3=-165.1+(-41.2)=-206.3kJ·mol-1;反应后气体体积变小,是一个熵减的反应(ΔS<0),由△H-T△S可知ΔH<0,ΔS<0在低温下能自发进行;
(2)反应①与反应③皆为放热反应,温废升高,平衡向左移动,使得CO的转化率减小;反应①正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,P3的转化率最大,则P3压强最大;故P3>P2>P1;
(3)由题意列“三段式”,
CO(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
起始量(mol):2 4 0 0
变化量(mol):x 3x x x
平衡量(mol):2-x 4-3x x x
反应达到平衡时,CH4与CO的体积分数相同,则:2-x=x,x=1,故v(H2)=1mol·L-1·min-1。
温度为T1时达到平衡状态时K1=1,当温度改变为T2时正逆反应速率相等,k正c(CO)c3(H2) =k逆c(CH4)·c(H2O),又k正=1.5k逆,则K2=1.5, K2>K1,该反应为放热反应,则T2<T1,故A错误;与I中H2的体积分数为25%相比,Ⅱ投料减半,相当于减小压强,平衡逆向移动,H2的体积分数应大于25%,故B错误;同时Ⅱ中α(CO)应小于容器I中α(CO),故D错误;Ⅲ中开始时浓度商=![]() ,反应正向进行,又该反应为气体体积减小反应,达平衡时总物质的量小于1+1+0.6+1.2=3.8mol,I中平衡时总物质的量为4mol,恒容恒温时气体压强之比等于其物质的量之比,故容器Ⅲ与容器I中的总压强之比小于19︰20,C项正确;
,反应正向进行,又该反应为气体体积减小反应,达平衡时总物质的量小于1+1+0.6+1.2=3.8mol,I中平衡时总物质的量为4mol,恒容恒温时气体压强之比等于其物质的量之比,故容器Ⅲ与容器I中的总压强之比小于19︰20,C项正确;
(4)甲烷燃料电池负极反应为CH4-8eˉ+ 2H2O ==CO2↑+8H+,转移16mol电子时负极产生2molCO2,与3molNaOH反应得1molNaHCO3和1molNa2CO3,由于水解程度:CO32->HCO3-,故离子浓度大小为c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】下列离子方程式表示的是盐类的水解且正确的是( )
A. HS-+H2O![]() H3O++S2-
H3O++S2-
B. HS-+H+===H2S
C. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是元素周期表中同一周期IIA和IIIA的两种元素,若甲的原子序数为X,则乙的原子序数不可能是( )
A. X+1B. X+13C. X+11D. X+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用十分广泛,从废旧钻酸锂(LiCoO2)锂离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题。现欲利用图19所示的工艺流程回收废旧电池中的某些金属资源(部分条件未给出)。回答下列问题:

已知:①滤液1中阳离子有H+、Co2+、Fe2+、Al3+、Li+等;
②两种物质不同温度下的溶解度如下表所示:

(1)钴酸锂( LiCoO2)钴元素的化合价为___________。
(2)浸泡时加入Na2SO3的主要目的是______________________;可用盐酸代替H2SO4和Na2SO3的混合液,但缺点是______________________。
(3)滤液1中加入NaClO3的主要目的是______________________(用离子方程式表示)。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mo·L-1时已沉淀完全)加入氨水调节pH的最小值是___________。(已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,1g3=0.52)
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是___________。
(6)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,利用如图所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为___________(填化学式)溶液;阳极电极反应式为______________________;电解过程中Li+向___________(填“A”或“B”)电极迁移。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”"
(1)Ti位于周期表的___________(填“s”“p”“d"或“ds")区,写出基态Ti的外围电子排布式:___________。
(2)月球岩石——玄武岩的主要成分为钛酸亚铁( FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。其中SO42-的 VSEPR模型为___________。
(3)TiCl2可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛作催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___________molσ键,与CO互为等电子体的离子是___________(填化学式,写一种)。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,该六棱柱底边边长为c cm,高为a cm,则:

①该晶胞中Ti的配位数为___________。
②该钛晶体的密度为______________________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国早期科技丛书《物理小识·金石类》写到:“青矾厂气熏人,衣服当之易烂,载木不盛,惟乌柏树不畏其气”,“青矾”则是绿矾,强热时发生如下反应:
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式___________,其最高能级上电子云形状是___________,上述四种元素电负性由大到小的顺序是___________,从结构的角度解释Fe3+稳定性强于Fe2+的原因是__________。
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是___________,空间构型是V形的分子是___________,属于非极性分子的是___________。
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是___________,若FeO与Fe2O3晶体类型相同,则二者熔点较高的物质是___________。
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);
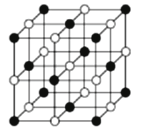
①该氧化物的化学式为___________。
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为___________(用含π的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com