
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__________而使Cu2O产率降低。
(2)已知:①2Cu(s)+ ![]() O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
O2(g)=Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+ ![]() O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
O2(g)=CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
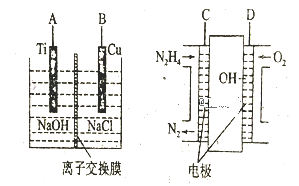
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
【答案】Cu +34.5kJ·mol-1 D 阴 2Cu-2e-+2OH-=Cu2O+H2O N2H4-4e-+4OH-=N2↑+4H2O
【解析】
(1)碳会将CuO还原为铜;
(2)根据盖斯定律进行求解;
(3)①铜电极应发生氧化反应;原电池中正极得电子发生还原反应,负极失电子发生氧化反应;
②离子交换膜要控制电解液中OH-的浓度,阴离子交换膜才能控制氢氧根浓度;
③原电池中负极失电子发生氧化反应。
(1)在加热条件下,C会将CuO还原为Cu,故方法I反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低;
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H=-169kJmol-1
O2(g)=Cu2O(s)△H=-169kJmol-1
②C(s)+![]() O2(g)=CO(g)△H=-110.5kJmol-1
O2(g)=CO(g)△H=-110.5kJmol-1
③Cu(s)+![]() O2(g)=CuO(s)△H=-157kJmol-1
O2(g)=CuO(s)△H=-157kJmol-1
根据盖斯定律①+②-2×2可得2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+34.5kJmol-1;
(3)①原电池中D电极通入氧气,氧气发生还原反应,故D电极为正极,C电极为负极;电解池中B电极为铜,铜在反应过程被氧化,故为阳极,与外接电源的正极相连,即与D相连,故答案为:D;
②该方法采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度;在电解池中,当阳极是活泼电极时,该电极本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O;
③原电池中负极失电子发生氧化反应,负极通入N2H4失电子被氧化成N2,负极反应式为N2H4-4e-+4OH-=N2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法, 错误的是
A.氢氟酸盛装在细口玻璃瓶中
B.氢氧化钠溶液装在用橡胶塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D.金属钠保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1 L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
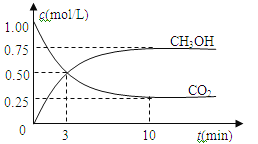
A.进行到3分钟时,正反应速率和逆反应速率相等
B.10分钟后容器中各物质浓度不再改变
C.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
D.3min前v正>v逆,3min后v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水。下列说法错误的是( )
A.步骤①后可依次用KSCN溶液和酸性KMnO4溶液来检测溶液中铁元素的价态
B.步骤②发生后,溶液的酸性增强
C.步骤③,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥可得到绿矾
D.为确保铁黄的产率,尽可能将步骤④中的pH值调大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
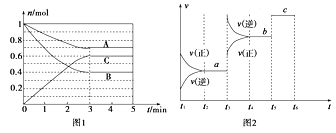
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
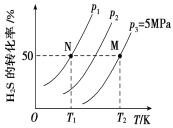
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO,下列叙述不正确的是
H++CH3COO,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入CaSO4和CO,在一定温度下,发生反应:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1

CO的反应速率随时间变化如图所示。下列说法正确的是( )
A.该反应是吸热反应,升高温度,正反应速率增大,逆反应速率减小
B.CaO是固态,不能用CaO表示反应的快慢
C.图示中t1时改变的条件可能是减小c(CO),同时增大c(SO2)
D.图示中t1时改变的条件可能是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com