
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是 ( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
科目:高中化学 来源: 题型:
 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,右图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,右图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是( )
A.铝罐将逐渐被腐蚀
B.碳粒和炭棒上发生的反应为:O2+4e-===2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下发生可逆反应A(g)+3 B(g)  2C(g),下列叙述中不能判断该反应达到平衡状态的是( )
2C(g),下列叙述中不能判断该反应达到平衡状态的是( )
A.C的生成速率与C的分解速率相等
B.单位时间内生成amolA,同时生成3amolB
C.A、B、C的浓度不再变化
D.单位时间内消耗amolA,同时生成3amolB
查看答案和解析>>
科目:高中化学 来源: 题型:
气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋的主要成分。A能发生以下转化。

(1)A结构简式 ;B、D分子中的官能团名称分别是__________、 _
(2)指出下列反应的反应类型① ; ③
(3)写出下列反应的化学方程式
② ,
③____
④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO和H2O。已知水是反应产物之一。
(1)该反应中的还原剂是____________。
(2)该反应中的还原产物是____________。
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目:________________________________________________________________________。
(4)若反应过程中转移了0.3 mol电子,则生成水的质量是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,生成的氯气的物质的量小于0.3 mol,为什么?
(2)将一Cu片投入稀H2SO4溶液中,没观察到反应现象,然后向其中加入少量的KNO3晶体,看到溶液由无色逐渐变蓝并有少量气泡产生,为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是 ( )
A.因为Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+ (2013·广东理综,10B)
B.工业上利用合成氨实现人工固氮不涉及氧化还原反应 (2012·广东理综,10C)
C.Na2O2用作呼吸面具的供氧剂不涉及氧化还原反应 (2012·广东理综,10A)
D.实验室用NH4Cl和Ca(OH)2制备NH3不涉及氧化还原反应 (2012·广东理综,10D)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可由软锰矿(主要成分为MnO2)制备KMn O4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
O4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是___________________________________。
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为__________________。生成0.1 mol还原产物时转移电子__________个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是__________________________________。
(3)KMnO4能与热的Na2C2O4(aq ,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品 0.165 g,能与0.335 g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为________________________________________________。
,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品 0.165 g,能与0.335 g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水热法制备Fe3O4纳米颗粒的总反应为:
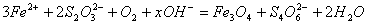 。下列说法正确的是( )。
。下列说法正确的是( )。
A.Fe2+、S2O32-都是还原剂 B.每生成1 mol Fe3O4,则转移电子数为3 mol
C.硫元素被氧化,铁元素被还原 D. x=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com