
ЁОЬтФПЁПАБЦјЪЧвЛжжживЊЕФЛЏЙЄВњЦЗЁЃ
(1)ЙЄвЕжагУТШЦјКЭЧтЦјдквЛЖЈЬѕМўЯТКЯГЩАБЦјЃЌгаЙиЗНГЬЪНШчЯТЃК 3H2 (g)+N2(g)2NH3 (g) + 92.4 kJ
ЂйЖдгкИУЗДгІЃКвЊЪЙЗДгІЮяОЁПЩФмПьЕФзЊЛЏЮЊАБЦјЃЌПЩВЩгУЕФЗДгІЬѕМўЪЧ__________ЃЌвЊЪЙЗДгІЮяОЁПЩФмЖрЕФзЊЛЏЮЊАБЦјЃЌПЩВЩгУЕФЗДгІЬѕМўЪЧ__________ЃК(ОљбЁЬюзжФИ)
AЃЎНЯИпЮТЖШBЃЎНЯЕЭЮТЖШCЃЎНЯИпбЙЧП DЃЎНЯЕЭбЙЧП EЃЎЪЙгУКЯЪЪЕФДпЛЏМС
ЙЄвЕЩЯЖдКЯГЩАБЪЪвЫЗДгІЬѕМўбЁдёЃЌЪЧзлКЯПМТЧСЫЛЏбЇЗДгІЫйТЪЁЂЛЏбЇЦНКтКЭЩшБИВФСЯЕШЕФгАЯьЁЃ
ЂкИУЗДгІДяЕНЦНКтКѓЃЌжЛИФБфЦфжавЛИівђЫиЃЌвдЯТЗжЮіжаВЛе§ШЗЕФЪЧ_______ЃК(бЁЬюзжФИ)
AЃЎЩ§ИпЮТЖШЃЌЖде§ЗДгІЕФЗДгІЫйТЪгАЯьИќДѓ
BЃЎдіДѓбЙЧПЃЌЖде§ЗДгІЕФЗДгІЫйТЪгАЯьИќДѓ
CЃЎМѕаЁЩњГЩЮяХЈЖШЃЌЖдФцЗДгІЕФЗДгІЫйТЪгАЯьИќДѓ
ЂлФГЛЏЙЄГЇЮЊСЫзлКЯРћгУЩњВњЙ§ГЬжаИБВњЦЗCaSO4ЃЌКЭЯрСкЕФКЯГЩАБГЇСЊКЯЩшМЦСЫжЦБИ(NH4)2SO4ЕФЙЄвеСїГЬ(ШчЭМ)ЃЌИУСїГЬжаЃК
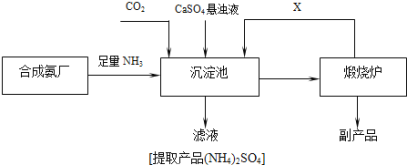
ЯђГСЕэГижаЭЈШызуСПЕФАБЦјЕФФПЕФЪЧ______________________________ЃЌПЩвдбЛЗЪЙгУЕФXЪЧ_______________ЁЃ(ЬюЛЏбЇЪН)
(2)ЪЕбщЪвжаПЩвдгУяЇбЮгыЧПМюЙВШШЕУЕНАБЦјЁЃгаЙиЕФРызгЗНГЬЪНЮЊ_____________________ЁЃ
Ђй0.01 mol/LЯѕЫсяЇШмвК0.5LЃЌгызуСПЕФЧтбѕЛЏФЦШмвКЙВШШЃЌПЩВњЩњАБЦј_____L(БъзМзДЬЌ)ЁЃ
ЂкШєгаЯѕЫсяЇКЭСђЫсяЇЕФЛьКЯШмвК0.5LЃЌгызуСПЕФЧтбѕЛЏФЦШмвКЙВШШЃЌПЩВњЩњАБЦј0.025molЃЛдкЗДгІКѓЕФШмвКжаМгШызуСПЕФТШЛЏБЕШмвКЃЌВњЩњ0.01 mol АзЩЋГСЕэЃЌдђдЛьКЯвКжаЃЌЯѕЫсяЇЕФХЈЖШЮЊ_______mol/LЁЃ
ЂлЯжгаЯѕЫсяЇЁЂТШЛЏяЇКЭСђЫсяЇЕФЛьКЯШмвКV LЃЌНЋЛьКЯШмвКЗжГЩСНЕШЗжЃКвЛЗнШмвКгызуСПЕФЧтбѕЛЏФЦШмвКЙВШШЃЌЙВВњЩњАБЦјA molЃЛСэвЛЗнШмвКжаТ§Т§ЕЮШыC mol/LЕФТШЛЏБЕШмвКB LЃЌШмвКжаSO42-ЧЁКУШЋВПГСЕэЃЛНЋГСЕэЙ§ТЫКѓЃЌдкТЫвКжаМЬајЕЮШыЯѕЫсвјШмвКжСЙ§СПЃЌгжВњЩњD molГСЕэЁЃдђдЛьКЯШмвКжаЃЌТШЛЏяЇЕФХЈЖШЮЊ________mol/LЃЌЯѕЫсяЇЕФХЈЖШЮЊ_______mol/LЁЃ(гУКЌгазжФИЕФДњЪ§ЪНБэЪО)
ЁОД№АИЁПACE BC A ЩњГЩе§бЮЃЌЪЙCa2+ЭъШЋГСЕэ CO2 NH4++OH-![]() H2O+NH3
H2O+NH3![]() 0.112 0.01
0.112 0.01 ![]()
![]()
ЁОНтЮіЁП
(1)ЂйвЊЪЙЗДгІЮяОЁПЩФмПьЕФзЊЛЏЮЊАБЦјЃЌашвЊМгПьЗДгІЫйТЪЃЌПЩвдЭЈЙ§Щ§ИпЮТЖШЁЂдіДѓбЙЧПКЭЪЙгУКЯЪЪЕФДпЛЏМСЪЕЯжЃЛвЊЪЙЗДгІЮяОЁПЩФмЖрЕФзЊЛЏЮЊАБЦјЃЌашвЊЗДгІе§ЯђвЦЖЏЃЌЗДгІ3H2 (g)+N2(g)2NH3 (g) + 92.4 kJЪЧЦјЬхЬхЛ§МѕаЁЕФЗХШШЗДгІЃЌПЩвдЭЈЙ§діДѓбЙЧПКЭНЯЕЭЮТЖШЪЕЯжЃЛ
ЂкИљОнгАЯьЦНКтвЦЖЏЕФЬѕМўЗжЮіХаЖЯЃЛ
ЂлдкЩЯЪіСїГЬЕФГСЕэГижаЭЈШызуСПАБЦјЕФФПЕФЪЧвЛЗНУцЬсЙЉЗДгІЮяЃЌСэвЛЗНУцЪЙШмвКГЪМюадгаРћгкCO2ЕФЮќЪеЃЌдкьбЩеТЏжаЗЂЩњCaCO3![]() CaO+CO2ЁќЃЌдђXЮЊCO2ПЩдкДЫжЦБИЪЕбщжабЛЗЪЙгУЃЛ
CaO+CO2ЁќЃЌдђXЮЊCO2ПЩдкДЫжЦБИЪЕбщжабЛЗЪЙгУЃЛ
(2)яЇбЮгыЧПМюЙВШШЕУЕНАБЦјКЭЫЎЃЛ
ЂйИљОнNH4+дЊЫиЪиКуМЦЫуЃЛ
ЂкИљОнNH4+дЊЫиЪиКуМЦЫуЃЛЃЛ
ЂлвЛЗнШмвКгызуСПЕФЧтбѕЛЏФЦШмвКЙВШШЃЌЙВВњЩњАБЦјA molЃЌИљОнNH4++OH-ЈTNH3+H2OПЩжЊУПЗнжаКЌгаAmolNH4+ЃЌгыТШЛЏБЕШмвКЭъШЋЗДгІЯћКФC mol/LBaCl2ШмвКB LЃЌИљОнBa2++SO42-ЈTBaSO4Ё§ПЩжЊУПЗнКЌгаSO42-CBmolЃЌНЋГСЕэЙ§ТЫКѓЃЌдкТЫвКжаМЬајЕЮШыЯѕЫсвјШмвКжСЙ§СПЃЌгжВњЩњD molГСЕэЃЌИљОнAg++Cl-=AgClЁ§ЃЌНсКЯЧАУцМгШыCBmolЕФBaCl2ШмвКПЩжЊЃЌУПЗнКЌгаCl-(D-2BC) molЁЃ
(1)ЂйвЊЪЙЗДгІЮяОЁПЩФмПьЕФзЊЛЏЮЊАБЦјЃЌашвЊМгПьЗДгІЫйТЪЃЌПЩвдЭЈЙ§Щ§ИпЮТЖШЁЂдіДѓбЙЧПКЭЪЙгУКЯЪЪЕФДпЛЏМСЪЕЯжЃЌЙЪбЁACEЃЛвЊЪЙЗДгІЮяОЁПЩФмЖрЕФзЊЛЏЮЊАБЦјЃЌашвЊЗДгІе§ЯђвЦЖЏЃЌЗДгІ3H2 (g)+N2(g)2NH3 (g) + 92.4 kJЪЧЦјЬхЬхЛ§МѕаЁЕФЗХШШЗДгІЃЌПЩвдЭЈЙ§діДѓбЙЧПКЭНЯЕЭЮТЖШЪЕЯжЃЌЙЪбЁBCЃЛ
ЂкA. ЗДгІ3H2 (g)+N2(g)2NH3 (g) + 92.4 kJЪЧЦјЬхЬхЛ§МѕаЁЕФЗХШШЗДгІЃЌЩ§ИпЮТЖШЗДгІФцЯђвЦЖЏЃЌЫЕУїЩ§ИпЮТЖШЃЌЖдФцЗДгІЕФЗДгІЫйТЪгАЯьИќДѓЃЌЙЪAДэЮѓЃЛ
B. ЗДгІ3H2 (g)+N2(g)2NH3 (g) + 92.4 kJЪЧЦјЬхЬхЛ§МѕаЁЕФЗХШШЗДгІЃЌдіДѓбЙЧПЗДгІЫйТЪМгПьЃЌЗДгІе§ЯђвЦЖЏЃЌЫЕУїдіДѓбЙЧПЖде§ЗДгІЕФЗДгІЫйТЪгАЯьИќДѓЃЌЙЪBе§ШЗЃЛ
C. МѕаЁЩњГЩЮяХЈЖШЃЌЗДгІФцЯђвЦЖЏЃЌЫЕУїМѕаЁЩњГЩЮяХЈЖШЖдФцЗДгІЕФЗДгІЫйТЪгАЯьИќДѓЃЌЙЪCе§ШЗЃЛ
ЙЪбЁAЁЃ
ЂлдкЩЯЪіСїГЬЕФГСЕэГижаЭЈШызуСПАБЦјЕФФПЕФЪЧвЛЗНУцЬсЙЉЗДгІЮяЃЌСэвЛЗНУцЪЙШмвКГЪМюадгаРћгкCO2ЕФЮќЪеЃЌдкьбЩеТЏжаЗЂЩњCaCO3![]() CaO+CO2ЁќЃЌдђXЮЊCO2ПЩдкДЫжЦБИЪЕбщжабЛЗЪЙгУЃЛ
CaO+CO2ЁќЃЌдђXЮЊCO2ПЩдкДЫжЦБИЪЕбщжабЛЗЪЙгУЃЛ
(2)яЇбЮгыЧПМюЙВШШЕУЕНАБЦјКЭЫЎЃЌРызгЗНГЬЪНЮЊЃКNH4++OH-![]() H2O+NH3
H2O+NH3![]() ЃЛ
ЃЛ
Ђй0.5L 0.01 mol/LЯѕЫсяЇШмвКжаЯѕЫсяЇЕФЮяжЪЕФСПЮЊЃК0.5L![]() 0.01 mol/L=0.005molЃЌИљОнNH4+ЪиКуЃЌзюЖрЩњГЩАБЦј0.005molЃЌБъПіЯТЕФЬхЛ§ЮЊЃК0.005mol
0.01 mol/L=0.005molЃЌИљОнNH4+ЪиКуЃЌзюЖрЩњГЩАБЦј0.005molЃЌБъПіЯТЕФЬхЛ§ЮЊЃК0.005mol![]() 22.4L/mol=0.112LЃЛ
22.4L/mol=0.112LЃЛ
ЂкгЩЬтвтПЩжЊЃЌдкЗДгІКѓЕФШмвКжаМгШызуСПЕФТШЛЏБЕШмвКЃЌВњЩњ0.01 mol BaSO4АзЩЋГСЕэЃЌЫЕУїдШмвКжаКЌгаСђЫсИљ0.01molЃЌЩшЯѕЫсяЇЕФЮяжЪЕФСПЮЊxmolЃЌИљОнNH4+ЪиКугаx+0.01mol![]() 2=0.025ЃЌЕУx=0.005molЃЌЯѕЫсяЇЕФХЈЖШЮЊ
2=0.025ЃЌЕУx=0.005molЃЌЯѕЫсяЇЕФХЈЖШЮЊ![]() =0.01mol/LЃЛ
=0.01mol/LЃЛ
ЂлвЛЗнШмвКгызуСПЕФЧтбѕЛЏФЦШмвКЙВШШЃЌЙВВњЩњАБЦјA molЃЌИљОнNH4++OH![]() mol/L =
mol/L =![]() mol/LЃЛУПЗнжаЯѕЫсИљЕФЮяжЪЕФСПЮЊЃК n(NH4+)- n(Cl-)-2n(SO42-)=
mol/LЃЛУПЗнжаЯѕЫсИљЕФЮяжЪЕФСПЮЊЃК n(NH4+)- n(Cl-)-2n(SO42-)=![]() ЃЌЯѕЫсяЇЕФХЈЖШЮЊ
ЃЌЯѕЫсяЇЕФХЈЖШЮЊ![]() mol/L =
mol/L = ![]() mol/LЁЃ
mol/LЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаа№Ъіжае§ШЗЕФЪЧ( )
A.32 g S8ЃЈЗжзгНсЙЙЃК![]() ЃЉжаЕФЙВМлМќЪ§ФПЮЊNA
ЃЉжаЕФЙВМлМќЪ§ФПЮЊNA
B.1LЁЂ0.1mol/LЕФNa2CO3ШмвКжаКЌвѕРызгзмЪ§ЮЊ0.1NAИі
C.БъзМзДПіЯТЃЌ22.4LHFКЌNAИіЗжзг
D.БъзМзДПіЯТЃЌ11.2 L Cl2ШмгкЫЎЃЌШмвКжаClЃЁЂClOЃКЭHClOЕФЮЂСЃЪ§жЎКЭЮЊNA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЧтбѕШМСЯЕчГиЗХЕчЪБЛЏбЇФмШЋВПзЊЛЏЮЊЕчФм
B. ЗДгІ4Fe(s)+3O2(g)![]() 2Fe2O3(s)ГЃЮТЯТПЩздЗЂНјааЃЌИУЗДгІЮЊЮќШШЗДгІ
2Fe2O3(s)ГЃЮТЯТПЩздЗЂНјааЃЌИУЗДгІЮЊЮќШШЗДгІ
C. 3 mol H2гы1 mol N2ЛьКЯЗДгІЩњГЩNH3ЃЌзЊвЦЕчзгЕФЪ§ФПаЁгк6ЁС6.02ЁС1023
D. дкУИДпЛЏЕэЗлЫЎНтЗДгІжаЃЌЮТЖШдНИпЕэЗлЫЎНтЫйТЪдНПь
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЫљЕУЕНЕФгаЛњВњЮяВЛЪЧДПОЛЮяЕФЪЧ![]()
A.МзЭщгыТШЦјдкЙтееЬѕМўЯТЕФШЁДњЗДгІ
B.ввЯЉгыЫЎдквЛЖЈЬѕМўЯТЕФМгГЩЗДгІ
C.![]() дкПеЦјжаМгШШ
дкПеЦјжаМгШШ![]() вдЭзїЮЊДпЛЏМС
вдЭзїЮЊДпЛЏМС![]() ЕФбѕЛЏЗДгІ
ЕФбѕЛЏЗДгІ
D.БНгызуСПЕФЧтЦјдквЛЖЈЬѕМўЯТЕФМгГЩЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЪЧгаЛњєШЫсбЮЃЌBЁЂCЁЂDЪЧГЃМћЛЏКЯЮяЃЛAЁЂBЁЂCЁЂDбцЩЋЗДгІГЪЛЦЩЋЃЌЦфЫЎШмвКОљГЪМюадЃЌBзюЧПЃЎXЁЂYЪЧзюГЃМћЕФбѕЛЏЮяЧвгыШЫЬхЁЂЩњУќЯЂЯЂЯрЙиЃЌЦфОЇЬхРраЭЯрЭЌЃЎвбжЊгаЙизЊЛЏШчЯТЃК
ЂйA(s)+B(s) ![]() C(s)+H2Ёќ
C(s)+H2Ёќ
ЂкD+H2![]() A+X
A+X
ЂлB+D=C+X
ЂмD(s)![]() C+X+Y(ОљЮДХфЦН)
C+X+Y(ОљЮДХфЦН)
зЂЃКRCOONa+NaOH![]() RHЁќ+Na2CO3
RHЁќ+Na2CO3
ЪдЛиД№ЯТСаЮЪЬтЃК
(1)CЕФУћГЦЪЧ ______ ЃЎ
(2)BЕФЕчзгЪНЪЧ ______ ЃЎ
(3)ЩЯЪіЂкДЂЧтЗНЗЈЕФЖўИізюУїЯдЕФгХЕуЪЧ ______ ЁЂ ______ ЕШЃЎ
(4)CЕФОЇЬхЪєгк ______ ОЇЬхЃЌДцдк ______ МќКЭ ______ МќЃЎ
(5)YЕФОЇЬхШлЛЏЪБНіПЫЗў ______ СІЃЎ
(6)XЕФОЇЬхжаЭЈГЃга ______ МќЕоКЯЃЌЙЙГЩ ______ ЬхПеМфЭјзДНсЙЙЃЌЦфЗаЕуБШЭЌжїзхЭЌРраЭЮяжЪвЊЬиБ№ ______ ЃЎ
(7)аДГі![]() ЕФЛЏбЇЗНГЬЪН ______ ЃЎ
ЕФЛЏбЇЗНГЬЪН ______ ЃЎ
(8)аДГідкCЕФБЅКЭШмвКжаВЛЖЯЭЈYЮіГіDЕФРызгЗНГЬЪН ______ ЃЎ
(9)гУРДБэДяХнФУ№Л№ЦїУ№Л№дРэ(D+Al3+)ЕФРызгЗНГЬЪНЪЧ ______ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЪЕбщВйзїЁЂЯжЯѓКЭНсТлЖМе§ШЗЕФЪЧЃЈ ЃЉ
бЁЯю | ЪЕбщВйзї | ЯжЯѓ | НсТл |
A | ЯЁЯѕЫсШмвКжаМгШыЙ§СПЬњЗлГфЗжЗДгІКѓЃЌЕЮМгKSCNШмвК | ШмвКБфЮЊбЊКьЩЋ | ЯЁЯѕЫсОпгабѕЛЏадЃЌФмНЋFeбѕЛЏГЩFe3+ |
B | ЯђAgNO3ШмвКжаЕЮМгЙ§СПАБЫЎ | ШмвКГЮЧх | Ag+гыNH3ЁЄH2OФмДѓСПЙВДц |
C | ЯђФГШмвКжаЕЮМгЯЁNaOHШмвКЃЌНЋЪЊШѓЕФКьЩЋЪЏШяЪджНжУгкЪдЙмПк | ЪджНБфРЖ | ИУШмвКжаДцдкNH4+ |
D | ЯђКЌгаЗгЬЊЕФNa2CO3ШмвКжаМгШыЩйСПЕФBaCl2ЙЬЬх | ШмвККьЩЋБфЧГ | жЄУїNa2CO3ШмвКжаДцдкЫЎНтЦНКт |
A. AB. BC. CD. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌНЋ 0.10 molЁЄL-1 бЮЫсЕЮШы 20.00 mL 0.10 molЁЄL-1 АБЫЎжаЃЌШмвКжа pH КЭ pOH ЫцМгШыбЮЫсЬхЛ§БфЛЏЧњЯпШчЭМЫљЪОЁЃвбжЊЃКpOHЃНЃlg c(OH-)ЃЌЯТСае§ШЗЕФЪЧ

A. M ЕуЫљЪОШмвКжаПЩФмДцдкc(Cl-)> c(NH4+)
B. N ЕуЫљЪОШмвКжаПЩФмДцдкЃКc (NH4+)+ c(NH3ЉqH2O)= c(Cl-)
C. Q ЕубЮЫсгыАБЫЎЧЁКУжаКЭ
D. M ЕуЕНQЕуЫљЪОШмвКжаЫЎЕФЕчРыГЬЖШЯШБфДѓКѓМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАЕЭЬМЩњЛюЁБЪЧжИМѕЩйФмдДЯћКФЁЂНкдМзЪдДЃЌДгЖјМѕЩйЖўбѕЛЏЬМХХЗХЕФЩњЛюЗНЪНЁЃЯТСаВЛЗћКЯЁАЕЭЬМЩњЛюЁБЕФзіЗЈЪЧЃЈ ЃЉ
A.гУРКзгДњЬцЫмСЯДќ B.ОГЃПЊГЕЩЯАр
B.ОГЃПЊГЕЩЯАр
C.ЪЙгУНкФмЕЦХн D.НкдМУПвЛЕЮЫЎ
D.НкдМУПвЛЕЮЫЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњЕчГиЕФФъЪаГЁЯћЗбСПдМЮЊ80вкжЛЃЌЦфжа70%ЪЧаПУЬИЩЕчГиЃЌРћгУЗЯОЩаПУЬИЩЕчГижЦБИСђЫсаПОЇЬх(ZnSO4ЁЄ7H2O)КЭДПMnO2ЕФЙЄвеШчЯТЭМЫљЪОЃК
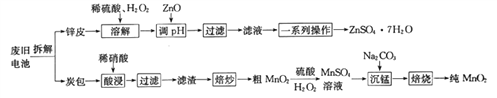
вбжЊЃК
ЂйаПЦЄЕФжївЊГЩЗжЮЊZnЃЌКЌгаЩйСПFeЃЛЬПАќЕФжївЊГЩЗжЮЊZnCl2ЁЂNH4ClЁЂMnO2ЁЂЬМЗлЕШЃЌЛЙКЌгаЩйСПЕФ CuЁЂAgЁЂFe ЕШЁЃ
ЂкKsp[Zn(OH)2]=2.0ЁС10-16ЃЛKsp[Fe(OH)2]=8.0ЁС10-16ЃЛKsp[Fe(OH)3]=4.0ЁС10-38ЁЃ
(1)Г§ШЅЬПАќжаЬМЗлЕФВйзїЮЊ_____________ЁЃ
A.ЫсНў B.Й§ТЫ C.БКГД D.БКЩе
(2)ДжMnO2зЊЛЏЮЊMnSO4ЪБЃЌжївЊЗДгІЕФРызгЗНГЬЪНЮЊ_____________________ЁЃ
(3)БКЩеЪБЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________ЁЃ
(4)жЦБИСђЫсаПОЇЬхСїГЬжаЃЌгУZnOЕїНкШмвКpHЕФФПЕФЪЧ______________________________ЃЌШєШмНтЪБВЛМгH2O2ДјРДЕФКѓЙћЪЧ____________________ЁЃ
(5)ЁАВнЫсФЦ-ИпУЬЫсМиЗЕЕЮЗЈЁБПЩВтЖЈMnO2ЕФДПЖШЃКШЁagMnO2бљЦЗгкзЖаЮЦПжаЃЌМгШыЪЪСПЯЁСђЫсЃЌдйМгШыV1mLc1molЁЄL-1Na2C2O4ШмвК(зуСП)ЃЌзюКѓгУc2molЁЄL-1ЕФKMnO4ШмвКЕЮЖЈЪЃгрЕФNa2C2O4ЃЌДяжеЕуЪБЯћКФV2 mLБъзМKMnO4ШмвКЁЃ
ЂйMnO2ВЮгыЗДгІЕФРызгЗНГЬЪНЮЊ_____________ЁЃ
ЂкИУбљЦЗжаMnO2ЕФжЪСПЗжЪ§ЮЊ__________________(МйЖЈдгжЪВЛВЮгыЗДгІЃЌСаГіБэДяЪНМДПЩ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com