
����Ŀ����һ�������½�0.01 molCH3COONa��0.005molHCl ����ˮ�����0.5 L�����Һ��
��1����Һ�й���________������
��2����Һ���������������ʵ���֮��һ������0.01 mol ��������____________��
��3����Һ��n ( CH3COO- ) + n ( OH- ) - n( H+ ) =_________mol��
�����������£�ȡŨ����ȵ�NaOH��HCl��Һ����3��2��������ͣ�������Һ��pH����12����ԭ��Һ��Ũ��Ϊ_________________ mol/L��
���𰸡�7 CH3COO- ��CH3COOH 0.005 0.05
��������
��1��0.01molCH3COONa��0.005molHCl����ˮ�õ�0.005molCH3COONa��0.005molCH3COOH��0.005molNaCl��CH3COONa��NaClΪǿ����ʣ�CH3COOHΪ������ʣ�
��2�����������غ���������
��3�����ݵ���غ������Һ��n��CH3COO-��+n��OH-��-n��H+����ֵ��
��������Ӧ����ҺpH=12����NaOH����������c��OH-��=![]()
��������Ϻ���������ԭ��Һ��Ũ�ȡ�
��һ����1��0.01molCH3COONa��0.005molHCl����ˮ�õ�0.005molCH3COONa��0.005molCH3COOH��0.005molNaCl��CH3COONa��NaClΪǿ����ʣ�CH3COOHΪ������ʣ�����Һ�д��ڵ�����Ϊ��Na+��H+��Cl-��OH-��CH3COO-�����ڵķ���Ϊ��H2O��CH3COOH��������7�ֲ�ͬ������
��ȷ�𰸣�7��
��2�����ݴ�����غ��֪��CH3COOH��CH3COO-�����������ʵ���֮�͵���0.01mol��
��ȷ�𰸣�CH3COOH��CH3COO-��
��3�����ݵ���غ��֪��n��Na+��+n��H+��=n��Cl-��+n��OH-��+n��CH3COO-����
����n��CH3COO-��+n��OH-��-n��H+��=n��Na+��-n��Cl-��=0.01mol-0.005mol=0.005mol��
��ȷ�𰸣�0.005��
��������NaOH xmol/L,HCLxmol/L���������NaOH 3V L,HCL 2VL
��Һ��PH����12 ��C��OH-��=Kw/C(H+)=1��10-14/10-12=0.01mol/L
�� x��3V -x��2V��/5V=0.01�õ�x=0.05mol/L��
��ȷ�𰸣�0.05��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵʳ���к�Ca2+��Mg2+�����ʣ�ij����ⱥ��ʳ��ˮ��ȡNaOH��Һ�Ĺ���������ͼ��ʾ���ش��������⣺
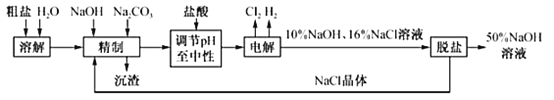
��1�������ơ������з�����Ӧ�����ӷ���ʽΪ_____
��2����������SO42������Ҳ�ϸߣ�������������_____������ĸ����Ҫ���Լ�Na2CO3֮_____���루�ǰ������
a��Ba��OH��2 b��Ba��NO3��2 c��BaCl2
��3���ڵ������У�����H2�ĵ缫����ӵ�Դ��_____����������ҺpH�����������_____�������������������������
��4���ռ�������ǵ�ⱥ��ʳ��ˮʱ���չ̶��ı���k�������ȣ����ɵIJ�Ʒ��������k��_____����д�������ʽ�ͽ���ҽ��������λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ճ���������;�dz��㷺���÷����ң���Al��Al2O3��Fe��Fe2O3��FeO �ȣ�Ϊԭ����ȡ�����Ĺ�����������ͼ���ش��������⣺
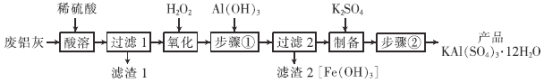
��֪��Fe3����ʼ������������ȫʱ��Һ��pH Ϊ1.9��3.7��
��1��������ˮ��ԭ����_______________________�������ӷ���ʽ��ʾ����
��2����������ʱ��Al2O3�ܽ�Ļ�ѧ����ʽΪ______________________��
��3����������ʱ��������Ӧ�����ӷ���ʽΪ_______________��
��4�������������Ŀ����______��������2������ϴ��ˮϴ����������գ��õ��IJ�Ʒ��������_____�����׳ƣ���
��5����������������IJ�����_________��__________�����˼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����O2��NH3�Ļ������448mLͨ�����ȵ�����������������������ַ�Ӧ����ͨ��������ˮ�������ռ���44.8mL O2��ԭ���������O2����������ǣ����谱ȫ��������������������ѻ���ɱ�״������ ��
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ��Һ�к���Fe(NO3)3��Cu(NO3)2��HNO3���������������ۣ���Һ��Fe2����Ũ����������۵����ʵ���֮��Ĺ�ϵ��ͼ��ʾ������Һ��Fe(NO3)3��Cu(NO3)2��HNO3���ʵ���Ũ��֮��Ϊ(����)
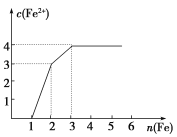
A. 1��1��1 B. 1��3��1
C. 3��3��8 D. 1��1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ԭ��������a g��һ��12Cԭ��������b g���谢���ӵ���������ֵΪNA������˵������ȷ���� ( )
A. ����ԭ�ӵ����ԭ��������12a/bB. ����ԭ�ӵ�Ħ��������aNAg
C. Wg����ԭ�ӵ����ʵ�����![]() molD. Wg����ԭ��������������10W/a
molD. Wg����ԭ��������������10W/a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ij�����ŷų��ж�����NOCl������ˮ�ͻ�����NO3-��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ_____��ˮԴ�е�NO3-�����ཡ�������Σ����Ϊ�˽���ˮԴ��NO3-��Ũ�ȣ����о���Ա�����ڼ��������������۽�NO3-��ԭΪN2���÷�Ӧ�����ӷ���ʽΪ____
������ij������FeCl3��Һ��ʴ����ͭ�ľ�Ե������ӡˢ��·��������Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+Cu==2FeCl2+CuCl2��ʵ��С���ͬѧ������ӡˢ��·��ķ�Һ�ɷֽ���������̽����
��ȡ������Һ���μ�KSCN��Һ�Ժ�ɫ��
��ȡ100mL��Һ������������AgNO3��Һ����������43.05g��
����ȡ100mL��Һ������һ��������ͭƬ����ַ�Ӧ���ͭƬ������������2.56g������Ӧ�����Һ�еμ�KSCN��Һ����ɫ��
����̽��ʵ��ó����ۣ�
��1����Һ�к��еĽ���������______��
��2��100mL��Һ��Cl-�����ʵ�����______��
��3��ԭ100mL��Һ��ͭ���ӵ����ʵ���Ũ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧ����2FeCl3+2KI===2FeCl2+2KCl+I2����2Fe+3Cl2![]() 2FeCl3����2KMnO4+16HCl(Ũ)===2KCl+2MnCl2+8H2O+5Cl2������ij��Һ����Fe2+��I��Cl��Ҫ������ȥI������ȥFe2+��Cl���ɼ�����Լ���
2FeCl3����2KMnO4+16HCl(Ũ)===2KCl+2MnCl2+8H2O+5Cl2������ij��Һ����Fe2+��I��Cl��Ҫ������ȥI������ȥFe2+��Cl���ɼ�����Լ���
A. Cl2B. KMnO4C. FeCl3D. HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·�����Ӧ����ѧ����ʽ���£�����ƽ��,Cu��2H2SO4(Ũ) ![]() CuSO4��A����2H2O,��ͨ����������������������⣺
CuSO4��A����2H2O,��ͨ����������������������⣺
��1���ڲμӷ�Ӧ�������У�����ԭ��������δ����ԭ����������ʵ���֮��Ϊ_________��A���ʿ�����ǿ�Ӧ�����κ�ˮ����AӦ������_________������ĸ������д����
a���� b���� c���� d������������ e������������
��2��һ������ͭƬ�뺬1.8mol H2SO4��ŨH2SO4��ַ�Ӧ��ŨH2SO4������������÷�Ӧ������ת����0.2 mol���ӣ����ɵ�A�����ڱ�״�������Ϊ _________L����������ȫ���ݳ�����
��3������2���з�Ӧ�����õ�����Һϡ�ͺ�������Ba(OH)2��Һ��Ӧ�����ó���������Ϊ________________g��д���˹����з�����Ӧ�Ļ�ѧ����ʽ��_______________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com