
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。
(一)乙烯是石油化工最重要的基础原料,请根据以下框图回答:
![]()
(1)乙烯分子的空间结构是_____________;C官能团名称是__________________。
(2)与乙烯和氢气的加成产物互为同系物的是_______(填写编号)。
a. C2H2 b. C6H6 c. C5H12 d. C2H6O
(3)A→B的化学方程式____________________________________。
(4)A+C→乙酸乙酯的化学方程式____________________________________。
(5) “乙烯→A”的反应类型是__________反应。下列物质在一定条件下都能与乙烯反应,其中反应类型与“乙烯→A”的不相同的是_____________(填序号)。
a.氢气 b.氯化氢 c.氧气 d.溴水
(6)实验室常用乙醇和浓硫酸共热制取乙烯,温度必须控制在_______________℃,加热时要使温度迅速上升至所需温度,其原因是____________________________________;实验时常在烧瓶中加入碎瓷片,目的是_______________________;实验室常用_________________法收集乙烯。
(二)煤焦油中可以分离出一种重要的液态烃——苯。
苯和液溴可以发生反应。根据下图装置回答:
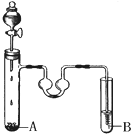
(1)现代化学认为苯分子中的碳碳键是________________________________________。
(2)反应时A试管内须放些铁丝,铁丝的作用是__________________________,A试管中发生的反应的化学方程式是 __________________________________________。
(3)双球U型管里盛放的液体是CCl4,其作用是_________________________________。
(4)当B试管盛放的是_____________(填序号),看到的现象是__________________,就可以证明该反应是取代反应。
a.硝酸银溶液 b.石蕊溶液 c.氢氧化钠溶液
【答案】平面结构 羧基 c 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O CH3COOH+CH3CH2OH
2CH3CHO + 2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 加成 c 170 防止乙醇和浓硫酸在140℃时发生分子间脱水生成乙醚 防暴沸 排水 介于单键和双键之间独特的化学键 催化作用
CH3COOCH2CH3+H2O 加成 c 170 防止乙醇和浓硫酸在140℃时发生分子间脱水生成乙醚 防暴沸 排水 介于单键和双键之间独特的化学键 催化作用 ![]() 除去HBr中混有的Br2 a 有淡黄色沉淀生成
除去HBr中混有的Br2 a 有淡黄色沉淀生成
【解析】
(一)乙烯与水在一定条件下发生加成反应生成的A为乙醇,乙醇催化氧化生成的B为乙醛,乙醛催化氧化生成的C为乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯;
(一)(1)乙烯分子结构中含有碳碳双键,空间结构是平面结构;C为乙酸,含有的官能团名称是羧基;
(2)乙烯和氢气的加成产物为乙烷,C5H12符合烷烃的通式,与乙烷互为同系物,而C2H2、C6H6均不符合烷烃的通式,C2H6O是烃的衍生物,故答案为c;
(3)A→B为乙醇催化氧化生成乙醛,发生反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O;
2CH3CHO + 2H2O;
(4)乙醇和乙酸发生酯化反应生成乙酸乙酯的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(5)乙烯与水在一定条件下发生加成反应生成乙醇,反应类型是加成反应;
a.氢气与乙烯可发生加成反应生成乙烷,故a错误;
b.氯化氢与乙烯可发生加成反应生成氯乙烷,故b错误;
c.乙烯在氧气中燃烧生成CO2和水,是氧化反应,故c正确;
d.溴水与乙烯可发生加成反应生成1,2-二溴乙烷,故d错误;
故答案为c;
(6)实验室常用乙醇和浓硫酸共热制取乙烯,温度必须控制在170℃,加热时要使温度迅速上升至所需温度,其原因是防止乙醇和浓硫酸在140℃时发生分子间脱水生成乙醚;实验时常在烧瓶中加入碎瓷片,目的是防暴沸;乙烯的收集常用排水法;
(二)(1)苯分子中的6个碳碳键完全相同,是介于单键和双键之间独特的化学键;
(2)苯和液溴需要在Fe作催化剂作用下发生取代反应生成溴苯,则铁丝的作用是催化作用,A试管中发生的反应的化学方程式是![]() ;
;
(3)溴易挥发,则双球U型管里盛放的CCl4,作用是除去HBr中混有的Br2;
(4)HBr能溶于硝酸银溶液生成淡黄色AgBr沉淀,则B试管盛放硝酸银溶液,当看到有淡黄色沉淀生成时,就可以证明该反应是取代反应。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】如图表示AlCl3溶液与NaOH溶液滴加过程中微粒数量的关系曲线。 判断下列说法不正确的是( )
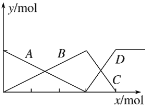
A.A线表示Al3+的物质的量的变化
B.x表示NaOH的物质的量
C.C线表示Al(OH)3的物质的量的变化
D.D线表示Al(OH)3的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是___。
A .Fe B.FeO C.Fe3O4 D.Fe2O3
(2)实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是___(用离子方程式表示)。
(3)某同学甲取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(4)同学乙认为甲同学的实验不够严谨,该同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是___。
(5)为测定某绿矾FeSO4.xH2O中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
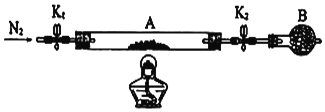
①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水数目x=___(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一:
材料二:
物质 | 熔点/℃ | 沸点/℃ | 密度/ | 溶解性 |
乙二醇 |
| 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填序号):
A. 蒸馏法 B. 萃取法 C. “溶解、结晶、过滤”的方法 D. 分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用_________。
②将乙二醇和丙三醇相互分离的最佳方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中加入新物质时, 其导电性(I)符合下图变化趋势的实验操作是
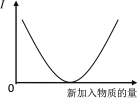
A. 乙酸溶液中通入氨气至过量
B. 石灰水中通入CO2至过量
C. 亚硫酸中通入氯气至过量
D. 氨水中通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置不能达到实验目的是
A.利用①吸收多余的氨气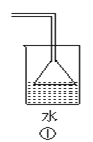
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥氨气
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0. 1 mol L-1 H2 A溶液中缓慢加入氢氧化钠(假设溶液体积不变),得到有关粒子的物质的量浓度分数与溶液pH值关系如图所示(M、N点对应的横坐标为6. 4和10.2)。 [![]() ]下列说法正确的是
]下列说法正确的是

A.Ka1(H2A)的数量级为10-5
B.N 点溶液中 c(Na+)>3c(HA-)
C.当溶液呈中性时,c(HA-)=c(Na+) >c(OH-)=c(H+)
D.由图可知HA-的水解程度小于电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com