
【题目】下列物质中会因见光而分解的是( )
A.NaHCO3B.Na2CO3C.H2SO4D.HC1O
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 非极性分子中一定含有非极性键
D. 元素的非金属性越强,其单质的活泼性一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原子晶体中只存在非极性共价键B. 稀有气体形成的晶体属于分子晶体
C. 干冰升华时,分子内共价键会发生断裂D. 金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
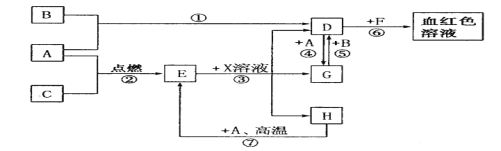
请回答下列问题:
(1)写出下列物质的化学式:A______、X______。
(2)在反应;① ~⑦中,属于氧化还原反应的有____个;反应⑥说明D溶液中含有___离子。
(3)反应④的离子方程式是__________。
(4)反应⑦的化学方程式是__________。
(5)检验D的溶液中是否含有G离子的方法是_________。
(6)除去D溶液中混有的少量G的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下列操作步骤进行提纯:

①先加入氧化剂X,再加入物质Y,过滤得沉淀Z。
②将滤液蒸发结晶得纯CuCl2·2H2O晶体。
已知:三种离子在溶液中完全变成氢氧化物沉淀所需pH值如下表。
离子 | Fe3+ | Cu2+ | Fe2+ |
pH | 3.7 | 6.4 | 6.4 |
试回答下列问题:
(1)加入氧化剂X的目的是______________________________________。
(2)下列物质都可以作为氧化剂,其中最适宜于本实验的是_________。
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
此过程发生反应的离子方程式为_____________________________________。
(3)物质Y可以用______________(填一种物质),沉淀Z是____________。
(4)为分离出沉淀Z采取的实验操作是_________________。
(5)步骤②所用的仪器有铁架台(含铁圈)、酒精灯、玻璃棒和_________,如要获得无水CuCl2,应采取的操作是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是( )

A. ab 段反应是:SO2+ 2 H2S="3S↓+2" H2O
B. 亚硫酸是比氢硫酸更弱的酸
C. 原H2S溶液的物质的量浓度为0.05 molL-1
D. b 点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
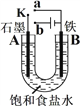
(1) 若开始时开关K与a连接,则A极的电极反应式为______________________________。
(2) 若开始时开关K与b连接,总反应的离子方程式为________________________________。
(3) 有关上述实验(2)的下列说法,正确的是(填序号)_________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4) 该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
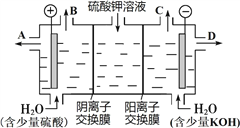
①该电解槽的阳极反应式为____________________________。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)______导出。
③若将甲醇和氢氧化钾溶液组合为甲醇燃料电池,则电池负极的电极反应式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2-硝基-1,3-苯二酚是橘黄色固体,易溶于水、溶液呈酸性,沸点为88℃,是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:

具体实验步骤如下:
①磺化:称取5.5g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60~65℃约15min。
②硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25±5) ℃左右继续搅拌15min。
③蒸馏:将反应混合物移入圆底烧瓶B中,小心加入适量的水稀释,再加入约0.1g尿素,然后用下图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇-水混合剂重结晶。
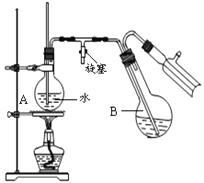
回答下列问题:
(1)实验中设计Ⅰ、Ⅲ两步的目的是__________________________。
(2)硝化步骤中制取“混酸”的具体操作是_________________________________________。
(3)写出步骤Ⅱ的化学方程式__________________________________________________.
(4)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能_____________.
(5)步骤②的温度应严格控制不超过30℃,原因是_________________________。
(6)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇-水混合剂洗涤。请设计简单的实验证明2-硝基-1,3-苯二酚已经洗涤干净:__________________________________________________。
(7)本实验最终获得1.55g橘黄色固体,则2-硝基-1,3-苯二酚的产率约为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com