
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
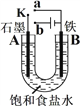
(1) 若开始时开关K与a连接,则A极的电极反应式为______________________________。
(2) 若开始时开关K与b连接,总反应的离子方程式为________________________________。
(3) 有关上述实验(2)的下列说法,正确的是(填序号)_________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4) 该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
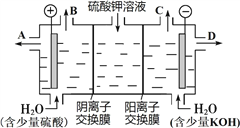
①该电解槽的阳极反应式为____________________________。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)______导出。
③若将甲醇和氢氧化钾溶液组合为甲醇燃料电池,则电池负极的电极反应式为_____________________________________。
【答案】 O2 + 2H2O + 4e- = 4OH- 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ ② 4OH--4e-=2H2O+O2↑ D CH3OH - 6e- + 8OH- = CO
2OH-+H2↑+Cl2↑ ② 4OH--4e-=2H2O+O2↑ D CH3OH - 6e- + 8OH- = CO![]() + 6 H2O
+ 6 H2O
【解析】(1)当关闭开关K与a连接时,石墨、铁棒、饱和食盐水(电解质溶液接近中性)组成了闭合回路,形成了原电池。其电极反应分别为:负极B(铁棒):Fe-2e-=Fe2+,正极A(石墨):O2 + 2H2O + 4e- = 4OH-;正确答案:O2 + 2H2O + 4e- = 4OH-。
(2)当关闭开关K与b连接时,电极A、B分别接了外接电源的正极和负极,组成了电解池。则阴离子Cl-、OH-向阳极A(石墨)附近移动,阳离子H+、Na+向阴极B(铁棒)附近移动,两极上分别发生的电极反应:阳极A(石墨):2Cl--2e-=Cl2↑;阴极B(铁棒): 2H++2e-=H2↑;上述过程实际上是电解氯化钠溶液,因此总反应的离子方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;正确答案:2Cl-+2H2O
2OH-+H2↑+Cl2↑;正确答案:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(3)溶液中Na+向阴极(B)移动;①错误;在阳极A(石墨)附近由于产生了氯气,因此能使湿润的淀粉碘化钾试纸变蓝,②正确;由于生成了氢气和氯气,因此要使电解质溶液恢复到原来的浓度,必须通入氯化氢气体,而不能加入盐酸,③错误;根据电子守恒原则,标准状况下B极产生的气体H2为2.24 L气体时,转移的电子数为0.2 mol电子,但是电子不能在溶液中进行转移,④错误;综上可知②正确;正确答案: ②。
(4) ①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气:4OH--4e-=2H2O+O2↑;正确答案: 4OH--4e-=2H2O+O2↑。
②电解时氢离子在阴极得电子生成氢气,则氢氧化钾在阴极生成,所以在D口导出;正确答案:D。
③甲醇和氢氧化钾溶液组合为甲醇燃料电池,甲醇做负极,发生氧化反应,电极反应式为CH3OH -6e- +8OH- = CO![]() +6H2O;正确答案:CH3OH -6e- +8OH- = CO
+6H2O;正确答案:CH3OH -6e- +8OH- = CO![]() + 6H2O。
+ 6H2O。
点睛: 当阳极材料为惰性电极时,溶液中的阴离子在此极放电,离子放电顺序为:S2>I->Br->Cl- >OH-;当阳极材料为金属材料时(金、铂除外),金属在阳极首先放电,溶液中的阴离子就不能放电。


科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
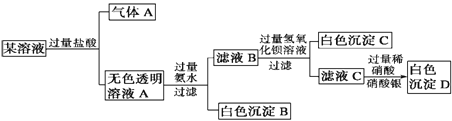
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式为: ,下列有关叙述正确的是 ( )
,下列有关叙述正确的是 ( )
A. 该化合物可与NaHCO3溶液反应放出CO2气体
B. 可与浓溴水反应,1 mol M最多消耗4 mol Br2
C. 可以发生氧化、加成、取代、加聚、缩聚反应
D. 可与NaOH溶液反应,1 mol M最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物[如FeCl3,Fe(OH)3,Na2FeO4等]在生产、生活中应用广泛,请结合所学知识,回答问题:
(1)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,检验FeCl3溶液中Fe3+存在的常用试剂是_______。FeCl3溶液腐蚀敷在绝缘板上的铜箔反应的离子方程式为________________,欲从腐蚀后的废液中回收Cu并重新获得FeCl3溶液,现有下列试剂①氯气②铁粉③浓硫酸④盐酸⑤烧碱⑥氨水,请选择试剂______,写出反应的离子方程式:废液中回收Cu_________;废液重新获得FeCl3溶液_________。
(2)沸水中逐滴加入1mol/L FeCl3溶液,继续加热至溶液呈透明的红褐色,该反应的化学方程式为____,该分散系中分散质的微粒直径为____ nm。
(3)高铁酸钠Na2FeO4是一种新型净水剂,可以通过如下反应制得2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,X的化学式为____,从化合价升降角度考虑,高铁酸钠能够杀菌是因为它具有____性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年7月22日京山泄洪,天门市黄潭镇多处村落被洪水淹没,灾情发生后天门市防疫站紧急组织救援小队开展消毒防疫工作,下列消毒采用的药品中属于强电解质的是
A. 漂白粉B. 碘水C. 双氧水D. 生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com