
【题目】下列属于热化学方程式的是( )
A.CaCO3→CaO + CO2-1185kJB.CaCO3(s)→CaO(s)+CO2(g)
C.CaCO3(s) →CaO(s)+CO2(g)-1185kJD.CaCO3→CaO+CO2
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 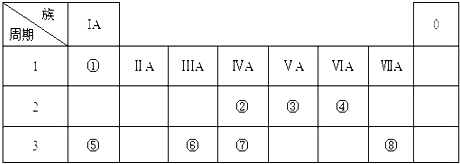
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)③的气态氢化物的电子式 .
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式、 .
(5)单质①在单质⑧中燃烧,火焰为色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 1mol氧气含1mol氧原子
D. 1mol氢含6.02×1023个H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X,Y,Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X,Y,Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X,Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子![]() 都具有相同的电子层结构,则下列叙述正确的是( )
都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C>D>B>A D. 单质的还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式 . 在图中,与A原子配位的氧原子数目为 .
(2)基态Cr原子的核外电子排布式为 , 其中电子的运动状态有种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2 , N和O的基态原子中,未成对的电子数目比为 .
(4)下表是几种碳酸盐的热分解温度和阳离子半径
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
请解释碳酸钙热分解温度最低的原因: .
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm.又知钙的密度为1.54gcm﹣3 , 则1cm3钙晶体中含有个晶胞,阿伏伽德罗常数为(列式计算).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对平衡2SO2(g)+O2(g)2SO3(g),采用下列措施一段时间后,能增大逆反应速率的是( )
A.通入大量O2
B.增大容器容积
C.移去部分SO3
D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有二氧化硫等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
I.为测定某工厂烟道气中SO2的含量,某兴趣小组同学做了如下实验:取标准状况下的烟气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1)写出氯水与二氧化硫反应的离子方程式__________。
(2)加入过量的BaCl2溶液的日的是:____________,写出相关反应的离子方程式:__________。
(3)洗涤沉淀的方法是____________。
(4)计算该烟气样品中二氧化硫的体积分数___________。
II.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(5)在工业上采用氨法烟气脱硫技术,其做法是用雾化的氨水与烟气中的SO2直接接触吸收SO2,请写出氨水吸收SO2生成亚硫酸铵的化学方程式_________。
(6)该兴趣小组同学采用NaClO2溶液脱除SO2
①NaClO2中氯元素的化合价为_______。
②用1L0.1mol/L的NaClO2溶液最多可以吸收标准状况下的SO2_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F,G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
元素 | 原子结构特征或有关物质的性质 |
A | 原子的最外层电子数是其内层电子数的2倍 |
B | 其单质是空气中含量最多的物质 |
C | 原子的最外层电子数是其电子层数的4倍 |
D | 位于第ⅡA族,其原子半径比E的大 |
E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
F | 原子序数16,其单质在通常状况下为固体 |
G | 原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是 . 这七种元素中,不属于主族元素的元素的名称是 .
(2)在E,F,G三种元素中,原子半径最小的是(填元素符号).
(3)元素A与G可形成化合物AG4 , 在该化合物中含有的化学键类型为 , 分子的空间结构为 . A与氧元素可形成化合物AO2 , 该化合物分子的电子式为 .
(4)元素B能与氢元素形成化合物BH3 , 在通常状况下,BH3的水溶液呈(填“酸”、“碱”或“中”)性,原因为(用方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com