
【题目】某同学设计了由乙醇合成乙二醇的路线如下。下列说法正确的是

A. X可以发生加成反应
B. 步骤①的反应类型是水解反应
C. 步骤②需要在氢氧化钠醇溶液中反应
D. 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国的矿产资源丰富。利用某冶炼废渣(主要成分为二氧化硅和锡、铜、铅、铁的氧化物)回收锡、铜、铅的工艺流程如下图所示:

回答下列问题:
(1)电炉冶炼时,焦炭的作用是________(填“氧化剂”或“还原剂”),将焦炭粉碎的目的是__________。熔剂的主要成分是氟石(CaF2),高温下能与SiO2反应生成两种钙盐,其中之一为 CaSiF6,该反应的化学方程式为____________________________。![]()
(2)脱铁后的溶液中含有少量的Sn2+,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为____________________________。
(3)已知SnO2不溶于稀硫酸。脱铁后氧化焙烧的目的是__________________。
(4)电解CuSO4溶液时,阳极的电极反应式为___________________________。
(5)已知H2CO3的一、二级电离常数分别为K1、K2,PbSO4、PbCO3的溶度积常数分别为Ksp(PbSO4)、Ksp(PbCO3)。锡、铅渣中的铅主要以PbSO4存在,脱硫时发生的反应为:
PbSO4(s)+HCO3ˉ(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
PbCO3(s)+H+(aq)+SO42-(aq),该反应的平衡常数K=___________(用上述已知常数表示)。脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是_____________________________。
(6)若该冶炼废渣中锡的质量分数为5%,30t废渣制得精锡lt,则锡的回收率为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟电渗析法将海水淡化的工作原理示意图如下。己知X、Y均为惰性电极,模拟海水中富含Na+、Cl—、Ca2+、Mg2+、SO42—等离子。下列叙述中不正确的是

A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为4OH——4e—=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g) ![]() xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。求:
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。求:
①2 s内用物质A表示的平均反应速率为________________。
②2 s内用物质B表示的平均反应速率为__________________________。
③2 s时物质B的转化率为______________________。
④x=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 的说法,正确的是( )
的说法,正确的是( )
A.该物质可由n个单体分子通过缩聚反应生成
B.![]() 该物质完全燃烧,生成33.6 L(标准状况)的
该物质完全燃烧,生成33.6 L(标准状况)的![]()
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.![]() 该物质与足量
该物质与足量![]() 溶液反应,最多可消耗
溶液反应,最多可消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D (放置有铁粉 )。请回答:
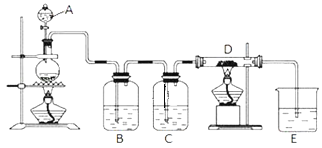
(1)烧瓶中反应的化学方程式是_____;
(2)装置B中盛放液体是_____,气体通过装置B的目的是_____;装置C中盛放的液体是_____,气体通过装置C的目的是_____;
(3)烧杯E中盛放的液体是_____;
(4)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O (g )剧烈反应;为收集D中产物,在D与E之间,除增加收集装置外,还需要增加_____装置;
(5)当电子转移的数目为6.02×1023个时生成的氯气的物质的量为_____mol,生成的氯气需用0.5mol/L的NaOH溶液_____L完全吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A | 配制480mL0.1mol/LCuSO4溶液 | 称取8.0g无水硫酸铜放在烧杯中,加入480mL的蒸馏水,用玻璃棒搅拌。 |
B | 除去氯化钠固体中少量的碳酸钙 | 加水稀盐酸、然后加热蒸干。 |
C | 提取碘水中的碘 | 用量筒量取一定量的碘水,倒入分液漏斗,注入四氯化碳,振荡、静置后分液。 |
D | 除去N2气体中的少量O2 | 点燃,然后将混合气体通入澄清石灰水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

A.反应的化学方程式为2N![]() M
M
B.t2时,正逆反应速率相等达到平衡状态
C.t1时,M的浓度是N浓度的2倍
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com