
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D (放置有铁粉 )。请回答:
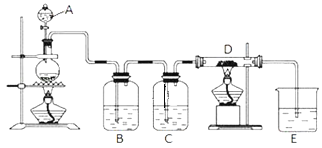
(1)烧瓶中反应的化学方程式是_____;
(2)装置B中盛放液体是_____,气体通过装置B的目的是_____;装置C中盛放的液体是_____,气体通过装置C的目的是_____;
(3)烧杯E中盛放的液体是_____;
(4)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O (g )剧烈反应;为收集D中产物,在D与E之间,除增加收集装置外,还需要增加_____装置;
(5)当电子转移的数目为6.02×1023个时生成的氯气的物质的量为_____mol,生成的氯气需用0.5mol/L的NaOH溶液_____L完全吸收。
【答案】MnO2+4HCl (浓)![]() MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 干燥氯气 NaOH溶液 干燥 0.5 2
MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 干燥氯气 NaOH溶液 干燥 0.5 2
【解析】
实验室用加热二氧化锰与浓盐酸方法制取氯气,因为浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,可以依次通过盛有饱和食盐水、浓硫酸的洗气瓶进行除杂,氯气与铁在加热条件下反应生成氯化铁,氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,据此分析解答。
(1)实验室用加热二氧化锰与浓盐酸方法制取氯气,二者加热生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl (浓) ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl (浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的B装置除去氯化氢,浓硫酸具有吸水性,可以干燥氯气,所以选择盛有浓硫酸的洗气瓶C除去水蒸气,故答案为:饱和NaCl溶液; 吸收氯气中混有的杂质HCl;浓硫酸;干燥氯气;
(3)氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,可以选择氢氧化钠溶液吸收过量的氯气,故答案为:NaOH溶液;
(4)生成的氯化铁:①受热易升华,冷却后易凝华;②遇H2O (g )剧烈反应,需要防止水蒸气进入装置D,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加干燥装置,防止装置E中水蒸气进入,故答案为:干燥;
(5)依据方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,则当电子转移的数目为6.02×1023个物质的量为1mol时,生成的氯气的物质的量为0.5mol,依据2NaOH+Cl2═NaCl+H2O+NaClO,0.5mol氯气消耗氢氧化钠1mol,用0.5mol/L的NaOH溶液体积为2L,故答案为: 0.5; 2.
MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,则当电子转移的数目为6.02×1023个物质的量为1mol时,生成的氯气的物质的量为0.5mol,依据2NaOH+Cl2═NaCl+H2O+NaClO,0.5mol氯气消耗氢氧化钠1mol,用0.5mol/L的NaOH溶液体积为2L,故答案为: 0.5; 2.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:
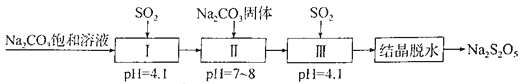
下列说法正确的是
A. 上述制备过程所涉及的物质中只有一种酸性氧化物
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了由乙醇合成乙二醇的路线如下。下列说法正确的是

A. X可以发生加成反应
B. 步骤①的反应类型是水解反应
C. 步骤②需要在氢氧化钠醇溶液中反应
D. 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝的混合物进行如下实验:
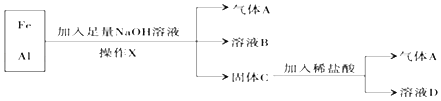
(1)操作X的名称是_____;
(2)气体A是_____ (填化学式 );
(3)加入足量NaOH溶液时发生反应的离子方程式为:_____;加入稀盐酸发生反应的离子方程式为:_____;
(4)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钼矿(含有MoS2、NiS2、NiS、FeS2、SiO2和C等)为我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。其冶炼工艺主要有氧化焙烧法和选择性还原熔炼法两种。过程如下图所示:
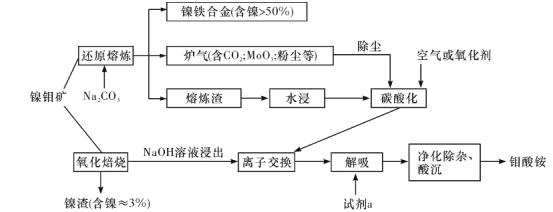
(1)选择性还原熔炼法比氧化焙烧法的优点有_________。
(2)还原熔炼时,FeS2发生的反应为3FeS2+6Na2CO3+11C+8O2![]() 3Fe+6Na2S+17CO2,写出NiS发生反应的化学方程式:______。
3Fe+6Na2S+17CO2,写出NiS发生反应的化学方程式:______。
(3)水浸液中主要含有Na2S、Na2MoO4、Na2CO3、Na2SiO3等,向其中通入适量CO2和空气,然后过滤,所得滤渣的主要成分为____。
(4)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10 mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是______。[已知Ksp( BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8]
(5)用阴离子交换树脂吸附、提取溶液中的钼,该树脂经解吸、除杂后,用盐酸或硝酸将其酸化至pH=1.5~2.5,可得到钼酸铵产品。试剂a可以是__________。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图所示:
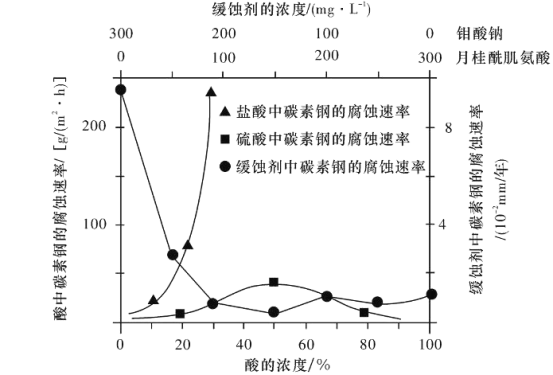
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为________。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.标况下,16gCH4含有分子数目为NA个
B.0.1 mol·L1氯化钠溶液含有的Na+数目为0.1NA
C.1 molH2O中含有质子数为10NA个
D.标况下,22.4L空气中含有分子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据如图所示的电解水原理进行实验,观察不同时间试管内的气体体积变化,则甲试管生成的气体是_______。

(2)假设电解了36g水,根据电解水的化学反应式计算生成氢气、氧气质量各为__________g;若在标况下,生成氢气、氧气体积各为_______________?
(3)根据实验观察和推算_______(“能”或“否”)得出初步结论:在相同温度和压强下,不同体积的O2和H2的其体积比等于其物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com