
【题目】镍钼矿(含有MoS2、NiS2、NiS、FeS2、SiO2和C等)为我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。其冶炼工艺主要有氧化焙烧法和选择性还原熔炼法两种。过程如下图所示:
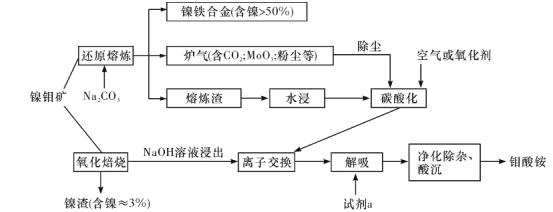
(1)选择性还原熔炼法比氧化焙烧法的优点有_________。
(2)还原熔炼时,FeS2发生的反应为3FeS2+6Na2CO3+11C+8O2![]() 3Fe+6Na2S+17CO2,写出NiS发生反应的化学方程式:______。
3Fe+6Na2S+17CO2,写出NiS发生反应的化学方程式:______。
(3)水浸液中主要含有Na2S、Na2MoO4、Na2CO3、Na2SiO3等,向其中通入适量CO2和空气,然后过滤,所得滤渣的主要成分为____。
(4)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10 mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是______。[已知Ksp( BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8]
(5)用阴离子交换树脂吸附、提取溶液中的钼,该树脂经解吸、除杂后,用盐酸或硝酸将其酸化至pH=1.5~2.5,可得到钼酸铵产品。试剂a可以是__________。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图所示:
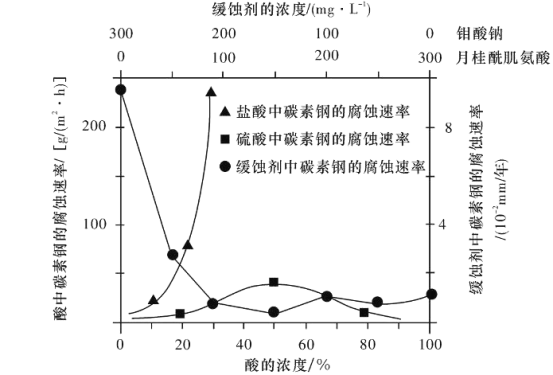
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为________。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是_________。
【答案】不生成SO2污染空气、直接将Mo与Ni和Fe分离、得到的镍铁合金中Ni的含量高 2NiS+2Na2CO3+C![]() 2Ni+2Na2S+3CO2↑ H2SiO3、S 90% NH3H2O 1:1 浓硫酸使铁钝化
2Ni+2Na2S+3CO2↑ H2SiO3、S 90% NH3H2O 1:1 浓硫酸使铁钝化
【解析】
(1)根据流程图中采用的选择性还原熔炼法产生的物质的成分分析判断;
(2)模拟FeS2的反应原理书写NiS反应方程式;
(3)根据O2的氧化性和碳酸的酸性比硅酸的酸性强分析;
(4)根据BaMoO4的溶度积常数和溶液中c(MoO42-)计算出溶液中c(Ba2+),再根据BaCO3和c(Ba2+)计算出溶液中c(CO32-),反应掉的c(CO32-)就是总的浓度减去溶液中c(CO32-),再根据去除率为反应掉的c(CO32-)的浓度占总浓度的百分比计算其数值;
(5)由钼酸钠溶液制备钼酸铵产品,用阴离子交换树脂进行交换出来的成分经NH3H2O解吸、除杂后,在用盐酸酸化,至pH=1.5~2.5,可得到钼酸铵产品;
(6)①碳素钢在缓蚀剂中腐蚀速率最小,缓蚀效果最好,钼酸钠和月桂酰肌氨酸的浓度比应为1:1;
②碳素钢中Fe在浓硫酸中发生钝化,形成致密的保护膜。
(1)根据流程图中采用的选择性还原熔炼法中S转化为Na2S进入熔渣,这样就不会产生SO2污染空气、直接将Mo与Ni和Fe分离、得到的镍铁合金中Ni的含量高;
(2)根据还原炼时,FeS2发生的反应3FeS2+6Na2CO3+11C+8O2![]() 3Fe+6Na2S+17CO2,可类推NiS在还原炼时产生Ni单质、Na2S和CO2,反应的方程式为:2NiS+2Na2CO3+C
3Fe+6Na2S+17CO2,可类推NiS在还原炼时产生Ni单质、Na2S和CO2,反应的方程式为:2NiS+2Na2CO3+C![]() 2Ni+2Na2S+3CO2↑;
2Ni+2Na2S+3CO2↑;
(3)空气中含有的O2有氧化性,会将Na2S氧化为单质S;由于碳酸的酸性比硅酸的酸性强,Na2SiO3与CO2及水发生反应产生H2SiO3,难溶于水,而Na2MoO4、Na2CO3能溶于水,因此得到的滤渣成分为H2SiO3、S;
(4)钼酸钠溶液中c(MoO42-)=0.40mol/L,Ksp(BaMoO4)=4×10-8,因此当溶液中MoO42-开始形成沉淀时,c(Ba2+)=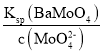 =
=![]() =1.0×10-7mol/L,此时由于Ksp(BaCO3)=1×10-9,溶液中c(CO32-)=
=1.0×10-7mol/L,此时由于Ksp(BaCO3)=1×10-9,溶液中c(CO32-)=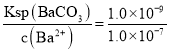 =0.010 mol/L,反应开始时c(CO32-)=0.10mol/L,所以c(CO32-)的去除率=(0.09mol/L÷0.10mol/L)×100%=90%;
=0.010 mol/L,反应开始时c(CO32-)=0.10mol/L,所以c(CO32-)的去除率=(0.09mol/L÷0.10mol/L)×100%=90%;
(5)用钼酸钠溶液制备钼酸铵,要用氨水解吸、除杂后,用盐酸或硝酸将其酸化至pH=1.5~2.5,可得到钼酸铵产品。试剂a可以是NH3H2O;/p>
(6)①碳素钢在缓蚀剂中腐蚀速率最小,缓蚀效果最好,由图可知当钼酸钠和月桂酰肌氨酸的浓度比为1:1,腐蚀速率最小,效果最优;
②当浓硫酸中硫酸浓度大于90%时,腐蚀速率几乎为0,原因是在室温下浓硫酸具有强的氧化性,能使碳素钢中Fe在浓硫酸中发生钝化,形成致密的保护膜,起到防止腐蚀的作用。


科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,![]() 的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是![]() 的氢化物
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素![]() 形成的离子
形成的离子
D. 常温下,![]() 三种元素形成的化合物的水溶液的
三种元素形成的化合物的水溶液的![]() 小于7
小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 的说法,正确的是( )
的说法,正确的是( )
A.该物质可由n个单体分子通过缩聚反应生成
B.![]() 该物质完全燃烧,生成33.6 L(标准状况)的
该物质完全燃烧,生成33.6 L(标准状况)的![]()
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.![]() 该物质与足量
该物质与足量![]() 溶液反应,最多可消耗
溶液反应,最多可消耗![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D (放置有铁粉 )。请回答:
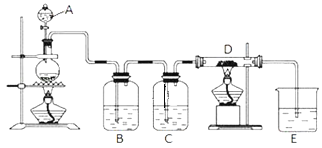
(1)烧瓶中反应的化学方程式是_____;
(2)装置B中盛放液体是_____,气体通过装置B的目的是_____;装置C中盛放的液体是_____,气体通过装置C的目的是_____;
(3)烧杯E中盛放的液体是_____;
(4)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O (g )剧烈反应;为收集D中产物,在D与E之间,除增加收集装置外,还需要增加_____装置;
(5)当电子转移的数目为6.02×1023个时生成的氯气的物质的量为_____mol,生成的氯气需用0.5mol/L的NaOH溶液_____L完全吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量的α—非兰烃和β—非兰烃,两者互为同分异构体,其相对分子质量为136。根据如下化学转化,回答相关问题:

已知: +R’CO2H
+R’CO2H
 +CO2
+CO2
(1)分别写出C→D和D→E的反应类型:___;___。
(2)写出B、F、H、β—非兰烃的结构简式:B:___;F:___;H:___;β—非兰烃:___。
(3)A的同分异构体中含有两个—COOCH3基团的化合物共有___种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为___。
(4)α—非兰烃与等物质的量的Br2进行加成反应的产物共有___种(不考虑立体异构)。
(5)写出C→M反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A | 配制480mL0.1mol/LCuSO4溶液 | 称取8.0g无水硫酸铜放在烧杯中,加入480mL的蒸馏水,用玻璃棒搅拌。 |
B | 除去氯化钠固体中少量的碳酸钙 | 加水稀盐酸、然后加热蒸干。 |
C | 提取碘水中的碘 | 用量筒量取一定量的碘水,倒入分液漏斗,注入四氯化碳,振荡、静置后分液。 |
D | 除去N2气体中的少量O2 | 点燃,然后将混合气体通入澄清石灰水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。

(1)D中的实验现象是_____________,C、E中溶液都褪色,分别体现SO2________、_______性质。
(2)请在方框中画出收集SO2以及尾气处理装置(标相关试剂)。___________
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀 不溶解,你认为留下的沉淀物是__________,形成该沉淀的反应方程式有:_________________________________________________________________________________
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及 时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑 浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是_____________

A.CO2 B.NH3 C.O3 D.N2 E.NO2
(4)SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气, 缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:
① 检验洗涤已经干净的实验操作是_________________________________________________。
② 试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
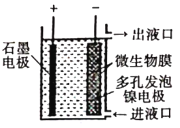
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com