
【题目】根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算铜元素相对原子质量。提供的实验仪器及试剂如下(根据需要可重复选用,加入的氯化铵与氢氧化钙的量足以产生使氧化铜完全还原的氨气):
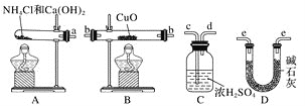
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为__。
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__。
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=__。
(4)在本实验中,使测定结果Ar(Cu)偏大的是__(填序号)。
①氧化铜未完全起反应 ②氧化铜不干燥 ③氧化铜中混有不反应的杂质 ④碱石灰不干燥 ⑤氯化铵与氢氧化钙混合物不干燥
(5)在本实验中,还可通过测定__和__,或__和__达到实验目的。
【答案】2NH3+3CuO![]() 3Cu+3H2O+N2↑ e→b→e
3Cu+3H2O+N2↑ e→b→e ![]() -16 ①③ m(CuO) m(Cu) m(Cu) m(H2O)
-16 ①③ m(CuO) m(Cu) m(Cu) m(H2O)
【解析】
(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,生成氮气、铜和水;
(2)根据题干可知需测定生成水的质量,生成的氨气需先通过碱石灰干燥、再在与氧化铜反应,最后用碱石灰吸收生成的水,以测得生成水的质量;
(3)由反应方程式可知氧化铜和水的物质的量相等,列出关系式计算即可;
(4)根据Ar(Cu)的表达式分析误差;
(1)氨气具有弱还原性,在加热条件下可以被氧化铜氧化,生成物为氮气、铜和水,反应的化学方程式为2NH3+3CuO![]() 3Cu+3H2O+N2↑,故答案为:2NH3+3CuO
3Cu+3H2O+N2↑,故答案为:2NH3+3CuO![]() 3Cu+3H2O+N2↑;
3Cu+3H2O+N2↑;
(2)因为需要测定反应后生成物水的质量,所以必需保证通入的氨气是纯净干燥的,由于浓硫酸可以与氨气反应,因此只能通过碱石灰进行干燥,再通入氧化铜进行反应,最后在通入碱石灰吸收反应生成的水,以测得生成水的质量,所以正确的顺序为a→e→b→e,故答案为: e→b→e;
(3)根据反应方程式2NH3+3CuO![]() 3Cu+3H2O+N2↑可知3mol CuO可生成3 H2O,可知氧化铜和水的物质的量相等,所以有以下关系式:
3Cu+3H2O+N2↑可知3mol CuO可生成3 H2O,可知氧化铜和水的物质的量相等,所以有以下关系式:![]() =
=![]() ,故解得Ar(Cu)=
,故解得Ar(Cu)=![]() =
=![]() ,所以答案为:
,所以答案为:![]() -16
-16
(4)由(3)可知得Ar(Cu)=![]() -16
-16
①若CuO未完全起反应,说明b偏小,结果偏大;
②若CuO不干燥,说明a偏小,b偏大,结果偏低;
③若CuO中混有不反应的杂质,说明b偏小,结果偏大;
④若碱石灰不干燥,说明氨气干燥不彻底,b偏大,结果偏低;
⑤若NH4C1与Ca(OH)2混合物不干燥,但只要氨气干燥彻底,对结果不影响,所以选项①③正确;答案:①③;
(5)根据2NH3+3CuO![]() 3Cu+3H2O+N2↑反应原理,可通过测定称量反应物氧化铜的质量m(CuO)和生成物铜的质量m(Cu)进行计算铜元素相对原子质量;也可以可通过测定称量生成物铜的质量m(Cu)和水的质量计算氧化铜的质量,进而计算铜元素相对原子质量;所以答案:m(CuO); m(Cu) ;m(Cu);m(H2O)。
3Cu+3H2O+N2↑反应原理,可通过测定称量反应物氧化铜的质量m(CuO)和生成物铜的质量m(Cu)进行计算铜元素相对原子质量;也可以可通过测定称量生成物铜的质量m(Cu)和水的质量计算氧化铜的质量,进而计算铜元素相对原子质量;所以答案:m(CuO); m(Cu) ;m(Cu);m(H2O)。


科目:高中化学 来源: 题型:
【题目】钠、铝和铁是三种重要的金属,回答问题:
(1)三种金属中,既能与盐酸反应又能与![]() 溶液反应_________(填化学式),写出它与
溶液反应_________(填化学式),写出它与![]() 溶液反应的离子方程式_________________。
溶液反应的离子方程式_________________。
(2)三种金属在一定条件下均能与水发生反应。写出铁与水蒸气反应的化学方程式__________。取一小块金属钠放入滴有酚酞的水中,可观察到的实验现象是_______________。(填字母序号)。
①钠浮在水面迅速反应
②钠沉在水底迅速反应
③钠熔成小球并迅速游动
④反应中可以听到嘶嘶的响声
⑤反应后的溶液变为红色
A.①④⑤ B.②③④⑤ C.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是![]()
A.使PH试纸变成红色的溶液,可能存在大量的:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() 溶液中,可能存在大量的:
溶液中,可能存在大量的:![]() 、
、![]() 、
、![]() 、
、![]()
C.硫酸酸化的淀粉KI溶液在空气中变成蓝色:![]()
D.![]() 溶液中滴加少量澄清石灰水:
溶液中滴加少量澄清石灰水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
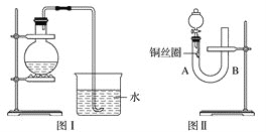
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
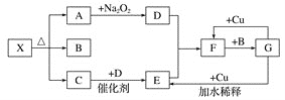
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C. 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D. 升高温度或加入催化剂,可以改变化学反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,二元酸H3PO3的pKa1、pKa2(pK=-lgK)依次为1.30、6.60,氨水的pKb为4.75。常温时,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1NH4H2PO3溶液中:c(H3PO3)>c(NH3·H2O)>c(H+)>c(OH-)
B.0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60:c(H2PO3-)=c(HPO32-)
C.0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0:c(NH4+)=c(H2PO3- )+c(HPO32-)
D.0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO3-)+2c(H3PO3)+0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学一次性完成N、C、Si的非金属性强弱的比较;乙同学完成了氧元素的非金属性比硫强的实验。
(1)从以下所给物质中选出甲同学设计的实验所用到物质:![]() 稀
稀![]() 溶液
溶液![]() 稀盐酸
稀盐酸![]() 碳酸钙
碳酸钙![]() 溶液
溶液![]()
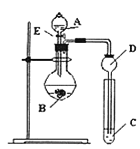
试剂A为______;试剂C为______![]() 填序号
填序号![]()
(2)乙同学设计的实验所用到试剂A为______;装置C中反应的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com