
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
【答案】CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-48.9 kJ·mol-1 CD K=
CH3OH(g) + H2O(g) ΔH =-48.9 kJ·mol-1 CD K=![]() < 250 d、f 温度 L1>L2 温度一定时,增大压强,CO2平衡转化率增大
< 250 d、f 温度 L1>L2 温度一定时,增大压强,CO2平衡转化率增大
【解析】
(1)根据盖斯定律书写热化学方程式并计算反应热;
(2)达到平衡状态时,正反应速率等于逆反应速率,各物质的浓度、物质的量等不随时间的变化而变化,据此分析判断;
(3)①平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值;
②根据表格中数据的变化关系确定该反应是吸热还是放热;
③根据三段法确定平衡时各物质的浓度,计算出平衡常数,进一步确定反应所处的温度;
(4)要提高CO的转化率,只需让反应平衡正向移动,由此分析判断;
(5)①由图象可知,CO2的转化率逐渐减小,根据温度或压强对平衡移动的影响进行分析;
②X代表温度,L表示压强,该反应为体积缩小的反应,温度一定时,增大压强,平衡正向移动,CO2平衡转化率增大。
(1)①CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
根据盖斯定律可知反应①+反应②可得CO2催化氢化合成甲醇的热化学方程式:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH =-48.9 kJ·mol-1;
H2O(g)+CH3OH(g) ΔH =-48.9 kJ·mol-1;
(2)A. 生成CH3OH的速率与消耗CO的速率相等,不能证明正反应速率等于逆反应速率,因此不能证明反应达到平衡状态,A项错误;
B.该反应中气体的重质量不变,容器为恒容的密闭容器,体积不变,因此混合气体的密度始终不变,因此混合气体的密度不变,不能证明反应达到平衡状态,B项错误;
C. 该反应为气体的物质的量减少的反应,气体的总质量不变,因此当混合气体的相对平均分子质量不变时,反应达到了平衡状态,C项正确;
D. CH3OH、CO、H2的浓度都不再发生变化时,证明反应达到平衡状态,D项正确;
答案选CD;
(3)①根据平衡常数的定义可知,该反应的平衡常数表达式为K=![]() ;
;
②由表格中数据可知,随着温度的升高.平衡常数逐渐减小,因此该反应为放热反应,即△H<0;
③根据已知条件可知:
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)

![]()
![]()
![]()
平衡常数K=![]() =
=![]() =2.041,与表格中数据对比可知,该反应的温度为250℃;
=2.041,与表格中数据对比可知,该反应的温度为250℃;
(4)a. 增加CO的浓度,平衡正向移动,但CO的转化率减小,a项错误;
b. 加入催化剂,反应速率加快,但平衡不移动,b项错误;
c. 该反应为放热反应,升高温度,平衡逆向移动,c项错误;
d. 加入H2,平衡正向移动,CO的转化率增大,d项正确;
e. 加入惰性气体,虽增大了压强,但容器的容积不变,各物质的浓度不发生变化,平衡不移动,CO的转化率不变,e项错误;
f. 分离出甲醇,减少了生成物的浓度,平衡正向移动,CO的转化率增大,f项正确;
答案选d、f;
(5)①由图象可知,CO2的转化率逐渐减小,该反应为放热反应,升高温度,平衡逆向移动,CO2的转化率逐渐减小,因此Xspan>代表温度,L表示压强;
②X代表温度,L表示压强,该反应为体积缩小的反应,温度一定时,增大压强,平衡正向移动,CO2平衡转化率增大。因此L1>L2。
化学反应 | mA(g)+nB(g)pC(g)+qD(g) | 是否平衡 |
正、逆反 应速率之 间的关系 | ①单位时间内消耗了m mol A,同时也生成了m mol A | 平衡 |
②单位时间内消耗了n mol B,同时也消耗了p mol C | 平衡 | |
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q | 不一定平衡 | |
④单位时间内生成了n mol B,同时也消耗了q mol D | 不一定平衡 | |
混合气体的平均相对分子质量 | ①平均相对分子质量一定,且m+n≠p+q | 平衡 |
②平均相对分子质量一定,且m+n=p+q | 不一定平衡 | |
气体密度(ρ) | ①只有气体参加的反应,密度保持不变(恒容密闭容器中) | 不一定平衡 |
②m+n≠p+q时,密度保持不变(恒压容器中) | 平衡 | |
③m+n=p+q时,密度保持不变(恒压容器中) | 不一定平衡 |


科目:高中化学 来源: 题型:
【题目】下列操作或试剂选择合理的是
A.可用蒸发结晶、趁热过滤的方法提纯含少量![]() 杂质的NaCl
杂质的NaCl
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含![]()
C.某碱性水样滴加稀盐酸无沉淀,再加![]() 溶液,出现白色沉淀,则原水样中一定含
溶液,出现白色沉淀,则原水样中一定含![]()
D.可用酸性![]() 溶液检验
溶液检验![]() 溶液中是否含有
溶液中是否含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
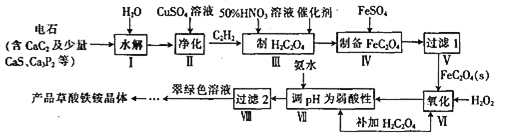
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) H1<0
② N2O4(l) ![]() 2NO2(g) H2 >0
2NO2(g) H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成可再生能源甲醇。其工艺流程如图所示:
反应生成可再生能源甲醇。其工艺流程如图所示:
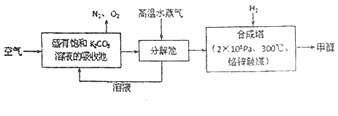
(1)进入分解池的主要物质名称是______。
(2)在合成塔中的反应条件下,若有4400g![]() 与足量
与足量![]() 反应,生成气态的
反应,生成气态的![]() 和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______。
和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______。
(3)该工艺中可以循环使用的原料是______。
(4)一定条件下,往2L恒容密闭容器中充入1mol![]() 和3mol
和3mol![]() ,发生上述合成甲醇的反应,要加快反应速率并提高
,发生上述合成甲醇的反应,要加快反应速率并提高![]() 的转化率,可以采取下列______措施
的转化率,可以采取下列______措施![]() 选填序号
选填序号![]()
①升温并加入催化剂
②降温并再加入![]()
③恒容将生成的甲醇和水液化
④加压并将生成的水液化
⑤恒容再充入1mol![]() 和
和![]()
(5)室温下,在吸收液碳酸钾溶液中加入适量醋酸调节溶液中![]() ,此时溶液中的
,此时溶液中的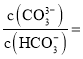 ______。
______。![]() :
:![]() ,
,![]() ,
,![]() :
:![]()
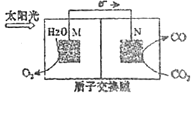
![]() 科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将
科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将![]() 转化为气体燃料CO,该装置工作时,N电极的电极反应式为______;若反应开始前交换膜两侧溶液质量相同,反应产生lmol氧气时,膜两侧溶液质量差为______g。
转化为气体燃料CO,该装置工作时,N电极的电极反应式为______;若反应开始前交换膜两侧溶液质量相同,反应产生lmol氧气时,膜两侧溶液质量差为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,实验室用如下原理制备:
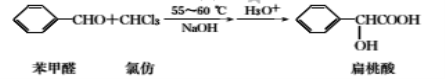
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、 氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。

步骤二:将反应液用200mL水稀释,每次用20mL。乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。
请回答下列问题:
(1)图中仪器C的名称是___。
(2)装置B的作用是___。
(3)步骤一中合适的加热方式是___。
(4)步骤二中用乙醚的目的是___。
(5)步骤三中用乙醚的目的是___;加入适量无水硫酸钠的目的是___。
(6)该实验的产率为___(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__,基态Ga原子核外电子占据最高能级的电子云轮廓图为___。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___。乙炔钠中存在___(填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____。写出和该阴离子互为等电子体的一种分子的结构式___。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___。
(6)某离子晶体的晶胞结构如图所示。
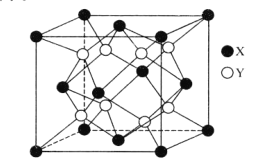
①晶体中在每个X周围与它最近且距离相等的X共有___个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中存在有:①N2H4+ H2O![]() N2H5++OH- K1②N2H5+ +H2O
N2H5++OH- K1②N2H5+ +H2O![]() N2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
N2H6++OH- K2。该溶液中的微粒的物质的量分数(X)随-lg c(OH-)变化的关系如图所示。则下列叙述不正确的是( )
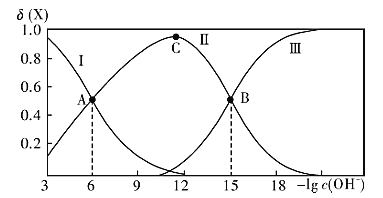
A.图中Ⅲ对应的微粒为N2H62+
B.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+ )
C.将10mL0.1mol/L的联氨溶液与5mL0.1mol/L.的盐酸溶液混合后,所得溶液pH等于8
D.常温下羟胺(NH2OH)的Kb=10-10,将少量联氨水溶液加入到足量NH3OHCl溶液中,发生的反应为N2H4+NH3OH+=N2H5+ +NH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com