
【题目】下图是汽车尾气催化转化装置工作原理示意图:
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A. 汽车尾气是雾霾成因之一,主要由CO、NO
B. 该过程中NO2既是生成物又是反应物
C. 整个过程中氧元素被还原,氮元素被氧化
D. 过程②中会有反应:
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH >HCO![]() ,其中不正确的是
,其中不正确的是
A.pH相等的四种溶液:a.CH3COONab.C6H5ONac.NaHCO3d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=4浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的
A. 硫酸铵溶液中加入浓氢氧化钠溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. 碳与浓硝酸反应:C+4H++NO3-=CO2↑+2NO↑+2H2O
C. 氨水与FeCl3反应:3OH-+Fe3+=Fe(OH)3↓
D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-恰好完全反应:2Ba2++4OH-+Al3++2SO42-=BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠在食品工业常用作肉类的发色剂,有一定的的氧化性,亚硝酸钠暴露于空气中会与氧气反应生成硝酸钠,一种模拟工业用纯碱溶液吸收氮氧化物制备NaNO2的实验装置如下:

已知:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O
回答下列问题:
(1)若当反应时NO与NO2的物质的量之比为1:1时,A中发生反应的化学方程式为________。
(2)装置B的作用是____________________;装置C中通入O2的目的是_______________。
(3)反应后A中溶液经蒸发浓缩、结晶及干燥得到产品。
甲同学取少量的产品溶于水并用稀盐酸酸化,用湿润的KI淀粉试纸检验,试纸变蓝,得出产品为NaNO2。乙同学认为结论不可靠,其理由是____________________________。
(4)现有V L某NaOH溶液能完全吸收n mol NO2和 m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为______________ mol/L。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHA的水溶液呈碱性,下列叙述正确的是( )
A. NaHA的电离方程式:NaHA=Na++H++A2—
B. HA—的水解方程式:HA—+H2O![]() H3O++A2—
H3O++A2—
C. 该溶液中离子的物质的量浓度关系:C(Na+)>C(HA—)>C(OH—)>C(H+)>C(A2—)
D. 该溶液中离子的物质的量浓度关系:C(Na+)+ C(H+)= C(HA—)+ C(A2—)+ C(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。

(1)打开K1关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为_________,装置B和D的作用是_________。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为___________________________。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3。若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和_________。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。

(1)装置G中Na2CO3与Na2S的最佳物质的量之比为_________。
(2)从左到右连接各仪器,接口顺序为:_________接g、h接_________、_________接_________、_________接d。
Ⅲ.常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得 BaCrO4沉淀;过滤洗涤后用适量稀酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,将Cr2O72-充分反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后加入淀粉溶液作指示剂,用0.0100mol/L的Na2S2O3溶液进行滴定:I2+2S2O32-===S4O62-+2I-。当溶液_________即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00m,则该废水中Ba2+的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c的最高价氧化物对应水化物可以反应
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
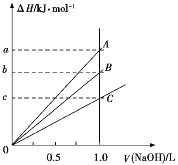
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
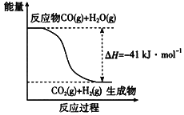
反应的热化学方程式为____________________________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ΔH=______________。
NH3(g) ΔH=______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=-393.5kJ·mol-1
CO2(g) ΔH1=-393.5kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=-571.6kJ·mol-1
2H2O(l) ΔH2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
298K时反应2C(s,石墨)+H2(g)![]() C2H2(g)的焓变:ΔH=_______________。
C2H2(g)的焓变:ΔH=_______________。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com