
【题目】硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。

(1)打开K1关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为_________,装置B和D的作用是_________。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为___________________________。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3。若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和_________。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。

(1)装置G中Na2CO3与Na2S的最佳物质的量之比为_________。
(2)从左到右连接各仪器,接口顺序为:_________接g、h接_________、_________接_________、_________接d。
Ⅲ.常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得 BaCrO4沉淀;过滤洗涤后用适量稀酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,将Cr2O72-充分反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后加入淀粉溶液作指示剂,用0.0100mol/L的Na2S2O3溶液进行滴定:I2+2S2O32-===S4O62-+2I-。当溶液_________即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00m,则该废水中Ba2+的物质的量浓度为_________。
【答案】浓硫酸 吸收SO2,防止污染空气 S+SO2+Na2CO3![]() Na2S2O3+CO2 NaHSO3 1:2 a b c e f 蓝色褪去且在半分钟内不恢复 0.00300mol/L
Na2S2O3+CO2 NaHSO3 1:2 a b c e f 蓝色褪去且在半分钟内不恢复 0.00300mol/L
【解析】
I.(1)A为二氧化硫的制备装置,C制取Na2S2O3,二氧化硫有毒,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气。
Ⅱ.(1)装置G中Na2CO3与Na2S的最佳物质的量之比由反应方程式中化学计量数之比确定;
(2)按I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气)确定连接装置的顺序。
Ⅲ.碘遇到淀粉呈蓝色,终点为蓝色褪去且在半分钟内不恢复;
按关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2 ~6S2O32-计算n(Ba2+),再由C=n/V计算浓度。
I.(1)A为二氧化硫的制备装置,故试剂甲为浓硫酸,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气。
(2)C中反应物SO2、Na2CO3溶液和硫粉,根据题意首先SO2和Na2CO3溶液发生反应生成Na2SO3和CO2,Na2SO3和S制Na2S2O3,总反应为:S+SO2+Na2CO3![]() Na2S2O3+CO2;
Na2S2O3+CO2;
若不及时关闭K1,将导致C中溶液呈酸性而发生副反应Na2S2O3+SO2+H2O=2NaHSO3+S↓。
Ⅱ(1)装置G中发生反应的方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,故Na2CO3和Na2S的最佳物质的量之比为1:2。
(2)需按下列顺序连接装置,I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气),所以各接口的顺序为:a接g、h接b、c接e、f接d。
Ⅲ向碘的淀粉蓝色溶液中滴加Na2S2O3溶液,滴定终点为蓝色褪去且在半分钟内不恢复。
相关物质转化的关系式为:2Ba2+~2BaCrO4~Cr2O72-~3I2 ~6S2O32-,n(Ba2+)=n(S2O32-)/3=18.00mL×0.0100mol/L/3=0.06mmol,c(Ba2+)=0.06mmol/20.00mL=0.00300mol/L


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。
(1)写出A的简单阴离子的电子式是________。
(2)E的氢化物与C单质相比,沸点较低的是_________(填化学式)。
(3)C、E组成的化合物所含化学键的类型是______________。
(4)B、D、E按原子半径由大到小的顺序排列为_____________(填元素符号)。
(5)E的最高价氧化物对应的水化物化学式是____________
(6)若D和E可组成化合物D2E2 ,在该化合物中各原子最外层均达到8电子稳定结构,写出其结构式__________________
(7)写出E在元素周期表中的位置____________________________________。
(8)将D的最高价含氧酸的浓溶液露置空气中,质量会发生变化,体现了其对应酸的_____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是汽车尾气催化转化装置工作原理示意图:
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A. 汽车尾气是雾霾成因之一,主要由CO、NO
B. 该过程中NO2既是生成物又是反应物
C. 整个过程中氧元素被还原,氮元素被氧化
D. 过程②中会有反应:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为_________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为_________和_________(各举一种,填化学式);在CO分子中,键与π键数目之比为_________。
(3)铁与K2O、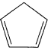 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
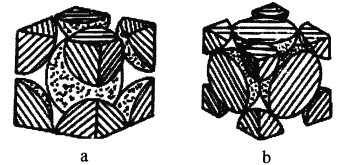
在图a所示堆积方式里铁原子的半径为rpm,则其晶胞棱长为_________cm。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为_________(用含圆周率π的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
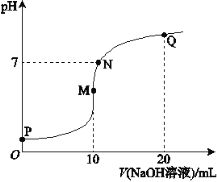
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com