
ЁОЬтФПЁПЬњЁЂюмЁЂФјОпгаЯрЫЦЕФаджЪЃЌдкЛЏбЇЩЯГЦЮЊЬњЯЕдЊЫиЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉLiCoO2ЁЂ LiFePO4ГЃгУзїяЎРызгЕчГиЕФе§МЋВФСЯЁЃЛљЬЌCoдзгКЫЭтЕчзгХХВМЪНЮЊ_________ЃЌЕкЫФЕчРыФмI4(Co) _________I4(Fe)(ЬюЁА>ЁБЛђЁА<ЁБ)ЃЌPO43ЃЕФПеМфЙЙаЭЮЊ_________ЁЃ
ЃЈ2ЃЉЬњЯЕдЊЫиФмгыCOаЮГЩFe(CO)5ЁЂNi(CO)4ЕШН№ЪєєЪЛљХфКЯЮяЁЃ
гыCOЛЅЮЊЕШЕчзгЬхЕФЗжзгКЭРызгЗжБ№ЮЊ_________КЭ_________(ИїОйвЛжжЃЌЬюЛЏбЇЪН)ЃЛдкCOЗжзгжаЃЌМќгыІаМќЪ§ФПжЎБШЮЊ_________ЁЃ
ЃЈ3ЃЉЬњгыK2OЁЂ (ЛЗЮьЖўЯЉ)дкИєОјПеЦјЬѕМўЯТЙВШШПЩжЦЕУЖўУЏЬњ[Fe(C5H5)2]ЁЃдкЛЗЮьЖўЯЉжаЃЌCдзгЕФдгЛЏЙьЕРРраЭЮЊ_________ЁЃЖўУЏЬњШлЕуЮЊ446KЃЌВЛШмгкЫЎЃЌвзШмгкввУбЁЂБНЁЂввДМЕШгаЛњШмМСЃЌ373KМДЩ§ЛЊЃЛДгИїжжаджЪПДЃЌЖМБэУїЫќЪЧЕфаЭЕФ_________ЛЏКЯЮяЁЃ
(ЛЗЮьЖўЯЉ)дкИєОјПеЦјЬѕМўЯТЙВШШПЩжЦЕУЖўУЏЬњ[Fe(C5H5)2]ЁЃдкЛЗЮьЖўЯЉжаЃЌCдзгЕФдгЛЏЙьЕРРраЭЮЊ_________ЁЃЖўУЏЬњШлЕуЮЊ446KЃЌВЛШмгкЫЎЃЌвзШмгкввУбЁЂБНЁЂввДМЕШгаЛњШмМСЃЌ373KМДЩ§ЛЊЃЛДгИїжжаджЪПДЃЌЖМБэУїЫќЪЧЕфаЭЕФ_________ЛЏКЯЮяЁЃ
ЃЈ4ЃЉЬњЕЅжЪЕФЖбЛ§ЗНЪНгаСНжжЃЌЦфЦЪУцЭМЗжБ№ШчЭМaЁЂbЫљЪОЁЃ
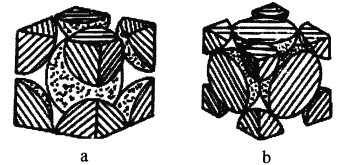
дкЭМaЫљЪОЖбЛ§ЗНЪНРяЬњдзгЕФАыОЖЮЊrpmЃЌдђЦфОЇАћРтГЄЮЊ_________cmЁЃ
дкЭМbЫљЪОЖбЛ§ЗНЪНРяЬњдзгЕФзмЬхЛ§еМОЇЬхЬхЛ§ЕФБШР§ЮЊ_________(гУКЌдВжмТЪІаЕФДњЪ§ЪНБэЪО)
ЁОД№АИЁП[Ar]3d74s2 < е§ЫФУцЬх N2 CN- 1ЃК2 sp2КЭsp3 ЙВМл ![]()
![]() Іа
Іа
ЁОНтЮіЁП
ЃЈ1ЃЉCoЮЊ27КХдЊЫиЃЌдзгКЫЭтЕчзгХХВМЪНЮЊ[Ar]3d74s2ЃЛ
Co3+КЫЭтЕчзгХХВМЮЊВЛЮШЖЈНсЙЙ3d4ЁЂНЯвзЪЇШЅЕчзгЃЌFe3+КЫЭтЕчзгХХВМЮЊАыТњЮШЖЈНсЙЙ3d5,НЯФбЪЇЕчзгЃЌгЩДЫБШНЯЕк4ЕчРыФмЃЛ
PO43-жаPдзгЙТЕчзгЖдЪ§ЮЊ0ЁЂІвМќЪ§ФПЮЊ4ЃЌгЩДЫШЗЖЈПеМфЙЙаЭЃЛ
(2)МлЕчзгЪ§КЭдзгЪ§ЯрЕШЕФСЃзгЛЅЮЊЕШЕчзгЬхЃЛCOгыN2ЕФЙЙЯрЫЦЃЌІвМќЁЂІаМќЪ§ЗжБ№ЮЊ1ЁЂ2ЃЛ
ЃЈ3ЃЉдкЛЗЮьЖўЯЉжага4ИіCдзгЮЊsp2дгЛЏ,1ИіCдзгЮЊsp3дгЛЏЃЛ
ЖўУЏЬњЕФШлЕу,ШмНтадЧщПіАќРЈФмЩ§ЛЊЕШаджЪгыЗжзгОЇЬхЯрЫЦЃЛ
ЃЈ4ЃЉЩшaОЇАћРтГЄЮЊx,4rpm=![]() xЃЌЧѓГіxЃЛЩшbОЇАћРтГЄЮЊyЃЌFeдзгАыОЖЮЊR,4R=
xЃЌЧѓГіxЃЛЩшbОЇАћРтГЄЮЊyЃЌFeдзгАыОЖЮЊR,4R=![]() yЃЌдйНсКЯЧђЬхЛ§ЙЋЪНМЦЫуЁЃ
yЃЌдйНсКЯЧђЬхЛ§ЙЋЪНМЦЫуЁЃ
Нт:ЃЈ1ЃЉCoЮЊ27КХдЊЫи,ЦфМлЕчзгХХВМЮЊ3d74s2,ЛљЬЌCoдзгКЫЭтЕчзгХХВМЪНЮЊ[Ar]3d74s2ЃЛ
Co3+КЫЭтЕчзгХХВМЮЊВЛЮШЖЈНсЙЙ3d4ЁЂНЯвзЪЇШЅЕчзгЃЌFe3+КЫЭтЕчзгХХВМЮЊАыТњЮШЖЈНсЙЙ3d5,НЯФбЪЇЕчзг,ЙЪl4(C0)<l4(Fe)ЃЛ
PO43-жаPдзгЙТЕчзгЖдЪ§ЮЊ0ЁЂІФМќЪ§ФПЮЊ4ЃЌЙЪЦфПеМфЙЙаЭЮЊе§ЫФУцЬхЃЛ
ЃЈ2ЃЉгыCOМлЕчзгЪ§КЭдзгЪ§ЯрЕШЕФЗжзггаN2,РызггаCN-,C22-ЕШЃЛCOгыN2ЕФЙЙЯрЫЦ,ІвМќЁЂІаМќЪ§ЗжБ№ЮЊ1ЁЂ2ЃЌІвМќгыІаМќЪ§ФПжЎБШЮЊ1ЃК2ЃЛ
ЃЈ3ЃЉдкЛЗЮьЖўЯЉжага4ИіCдзгЮЊsp2дгЛЏ,1ИіCдзгЮЊsp3дгЛЏЃЌЖўУЏЬњЕФШлЕуЁЂШмНтадЧщПіАќРЈФмЩ§ЛЊЕШаджЪЃЌЖМБэУїЫќЪЧЕфаЭЕФЙВМлЛЏКЯЮяЃЛ
(4)ЩшaОЇАћРтГЄЮЊx,4rpm=![]() xМДx=
xМДx=![]() rpm=
rpm=![]() rЁС10-10cmЃЌ
rЁС10-10cmЃЌ
ЩшbОЇАћРтГЄЮЊyЃЌFeдзгАыОЖЮЊR,4R=![]() yЃЌМДR=
yЃЌМДR=![]() yЃЌОЇАћКЌгаЕФдзгЪ§ЮЊ(8ЁС1/8+6ЁС1/2)=4,дзгзмЬхЛ§ЮЊ
yЃЌОЇАћКЌгаЕФдзгЪ§ЮЊ(8ЁС1/8+6ЁС1/2)=4,дзгзмЬхЛ§ЮЊ![]() =
=![]() Іаy3,ЬњдзгЕФзмЬхЛ§еМОЇЬхЬхЛ§ЕФБШР§ЮЊ
Іаy3,ЬњдзгЕФзмЬхЛ§еМОЇЬхЬхЛ§ЕФБШР§ЮЊ![]() ІаЁЃ
ІаЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКX(g)+2Y(g)![]() 3Z(g) ЁїH=-akJЁЄmol-1(a>0)ЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
3Z(g) ЁїH=-akJЁЄmol-1(a>0)ЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. 0.1molXКЭ0.2molYГфЗжЗДгІЩњГЩZЕФЮяжЪЕФСПвЛЖЈаЁгк0.3mol
B. ДяЕНЛЏбЇЦНКтзДЬЌЪБЃЌXЁЂYЁЂZЕФХЈЖШВЛдйЗЂЩњБфЛЏ
C. ДяЕНЛЏбЇЦНКтзДЬЌЪБЃЌЗДгІЗХГіЕФзмШШСППЩДяa Kj
D. Щ§ИпЗДгІЮТЖШЃЌФцЗДгІЫйТЪдіДѓЃЌе§ЗДгІЫйТЪМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПBa(OH)2(ЙЬЬх)ЁЂCuSO4(ЙЬЬх)ЁЂДПH2SO4(вКЬЌ)ЙщЮЊвЛРрЃЌЯТСаФФжжЮяжЪПЩвдКЭЫќУЧЙщЮЊвЛРрЃЈ ЃЉ
A.75%ЕФОЦОЋШмвКB.ТШЛЏФЦC.ЯЁбЮЫсD.ФрНЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃК
A. 28gОлввЯЉжаКЌгаNAИіЬМЬМЫЋМќ
B. 1molввЯЉгыCl2ЭъШЋМгГЩЃЌШЛКѓгыCl2ЗЂЩњШЁДњЗДгІЃЌЙВЯћКФТШЦјЕФЗжзгЪ§зюЖрЮЊ6NA
C. БъзМзДПіЯТЃЌ2.24LCCl4жаЕФдзгзмЪ§Дѓгк0.5NA
D. 15gМзЛљКЌгаЕФЕчзгЪ§ЪЧ9NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђДњСђЫсФЦ(Na2S2O3)дкЩњВњЩњЛюжаОпгаЙуЗКгІгУЁЃЛиД№ЯТСаЮЪЬтЃК
I.ЙЄвЕЩЯЦеБщЪЙгУNa2SO3гыСђЛЧЙВжѓжЦБИNa2S2O3ЃЌзАжУШчЭМ1ЁЃ

ЃЈ1ЃЉДђПЊK1ЙиБеK2ЃЌЯђдВЕзЩеЦПжаМгШызуСПЪдМСМзВЂМгШШЁЃЪдМСМзЮЊ_________ЃЌзАжУBКЭDЕФзїгУЪЧ_________ЁЃ
ЃЈ2ЃЉЪМжеБЃГжCжаШмвКГЪМюадЁЂМгШШВњЩњNa2S2O3ЃЌЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________________________ЁЃЗДгІвЛЖЮЪБМфКѓЃЌCжаСђЗлж№НЅМѕЩйЃЌМАЪБДђПЊK2ЁЂЙиБеK1ВЂЭЃжЙМгШШЃЌНЋCжаЫљЕУЛьКЯЮяЗжРыЬсДПКѓМДЕУЕНNa2S2O3ЁЃШєВЛМАЪБЙиБеK1ЃЌНЋЕМжТCжаШмвКГЪЫсадЁЂЗЂЩњИБЗДгІВњЩњSКЭ_________ЁЃ
Ђђ.РћгУSO2гыNa2CO3ЁЂNa2SЕФЛьКЯШмвКЗДгІвВФмжЦБИNa2S2O3ЃЌЫљашвЧЦїШчЭМ2ЁЃ

ЃЈ1ЃЉзАжУGжаNa2CO3гыNa2SЕФзюМбЮяжЪЕФСПжЎБШЮЊ_________ЁЃ
ЃЈ2ЃЉДгзѓЕНгвСЌНгИївЧЦїЃЌНгПкЫГађЮЊЃК_________НгgЁЂhНг_________ЁЂ_________Нг_________ЁЂ_________НгdЁЃ
Ђѓ.ГЃгУNa2S2O3ШмвКВтЖЈЗЯЫЎжаBa2+ХЈЖШЁЃ
ШЁЗЯЫЎ20.00mLЃЌПижЦЪЪЕБЕФЫсЖШМгШызуСПK2Cr2O7ШмвКЃЌЕУ BaCrO4ГСЕэЃЛЙ§ТЫЯДЕгКѓгУЪЪСПЯЁЫсШмНтЃЌДЫЪБCrO42ЃШЋВПзЊЛЏЮЊCr2O72ЃЃЛдйМгЙ§СПKIШмвКЃЌНЋCr2O72ЃГфЗжЗДгІЃКCr2O72Ѓ+6IЃ+14H+=3I2+2Cr3++7H2OЁЃШЛКѓМгШыЕэЗлШмвКзїжИЪОМСЃЌгУ0.0100mol/LЕФNa2S2O3ШмвКНјааЕЮЖЈЃКI2+2S2O32Ѓ===S4O62Ѓ+2IЃЁЃЕБШмвК_________МДЮЊжеЕуЁЃЦНааЕЮЖЈ3ДЮЃЌЯћКФNa2S2O3ШмвКЕФЦНОљгУСПЮЊ18.00mЃЌдђИУЗЯЫЎжаBa2+ЕФЮяжЪЕФСПХЈЖШЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЪЕбщЪвдкСйЪБХфжЦвЛаЉТШЛЏЬњШмвКЪБЃЌГЃНЋТШЛЏЬњЙЬЬхЯШШмгкНЯХЈЕФбЮЫсжаЃЌШЛКѓдйгУеєСѓЫЎЯЁЪЭЕНЫљашЕФХЈЖШЃЌЪЧЮЊСЫ_________________ЃЈЬюЁАДйНјЁБЁЂЁАвжжЦЁБЃЉЫЎНтЁЃТШЛЏЬњЫЎШмвКГЪ______ЃЈЬюЁАЫсЁБЁЂЁАжаЁБЁЂЁАМюЁБЃЉадЃЌГЃЮТЪБЕФpH _____7ЃЈЬюЁА>ЁБЁЂЁА=ЁБЁЂЁА<ЁБЃЉЃЌдвђЪЧЃЈгУРызгЗНГЬЪНБэЪОЃЉЃК______________________________ЁЃ
ЃЈ2ЃЉГЃЮТЯТЃЌpH=2ЕФФГЫсHnA(AЮЊЫсИљ)гыpH=12ЕФФГМюB(OH)mЕШЬхЛ§ЛьКЯЃЌЧЁКУЗДгІЩњГЩе§бЮЃЌЛьКЯШмвКЕФpH=10ЃЎЗДгІЩњГЩе§бЮЕФЛЏбЇЪНЮЊ___________ ЃЌИУбЮжа___________ЃЈЬюРызгЗћКХЃЉвЛЖЈФмЫЎНтЃЌЦфЫЎНтЕФРызгЗНГЬЪНЮЊ____________________ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБШНЯ1molЕЊЦјКЭ1molвЛбѕЛЏЬМЕФЯТСаЮяРэСПЃКЂйжЪСПЃЛЂкЗжзгзмЪ§ЃЛЂлдзгзмЪ§ЁЃЦфжаЯрЭЌЕФЪЧЃЈ ЃЉ
A.ЂйB.ЂйЂкC.ЂкЂлD.ЂйЂкЂл
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЪБЃЌVIAдЊЫиЕЅжЪгыH2ЗДгІЩњГЩЦјЬЌH2XЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
![]() O2(g) +H2(g) ЃНH2O(g)
O2(g) +H2(g) ЃНH2O(g) ![]() HЃНЃ242kJЁЄmolЃ1
HЃНЃ242kJЁЄmolЃ1
S(g)+ H2(g) ЃНH2S(g) ![]() HЃНЃ20kJЁЄmolЃ1
HЃНЃ20kJЁЄmolЃ1
Se(g)+H2(g)![]() H2Se(g)
H2Se(g) ![]() HЃН+81kJЁЄmolЃ1
HЃН+81kJЁЄmolЃ1
ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЮШЖЈадЃКH2O< H2S< H2Se
B. НЕЮТгаРћгкSeгыH2ЗДгІЩњГЩH2Se
C. O2(g)+2H2S(g)ЃН2H2O(g)+2S(g) ![]() HЃНЃ444 kJЁЄmolЃ1
HЃНЃ444 kJЁЄmolЃ1
D. ЫцзХКЫЕчКЩЪ§ЕФдіМгЃЌVIAзхдЊЫиЕЅжЪгыH2ЕФЛЏКЯЗДгІдНШнвзЗЂЩњ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаЃЌЫљКЌЗжзгЪ§зюЖрЕФЪЧ
A. 22.4L O2(БъзМзДПі) B. 1.6 g H2
C. 1.2 mol H2SO4 D. 28g CaO
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com