
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是:
A. 28g聚乙烯中含有NA个碳碳双键
B. 1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气的分子数最多为6NA
C. 标准状况下,2.24LCCl4中的原子总数大于0.5NA
D. 15g甲基含有的电子数是9NA
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g) ![]() N2O4(g) ΔH<0,下列说法正确的是( )
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
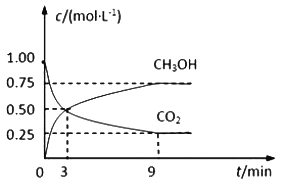
(1)从3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。
(1)写出A的简单阴离子的电子式是________。
(2)E的氢化物与C单质相比,沸点较低的是_________(填化学式)。
(3)C、E组成的化合物所含化学键的类型是______________。
(4)B、D、E按原子半径由大到小的顺序排列为_____________(填元素符号)。
(5)E的最高价氧化物对应的水化物化学式是____________
(6)若D和E可组成化合物D2E2 ,在该化合物中各原子最外层均达到8电子稳定结构,写出其结构式__________________
(7)写出E在元素周期表中的位置____________________________________。
(8)将D的最高价含氧酸的浓溶液露置空气中,质量会发生变化,体现了其对应酸的_____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是

A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氯代物1种、二氯代物有3种
C. 立方烷是苯(C6H6)的同系物,也是苯乙烯(C6H5-CH=CH2)的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为_________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为_________和_________(各举一种,填化学式);在CO分子中,键与π键数目之比为_________。
(3)铁与K2O、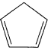 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
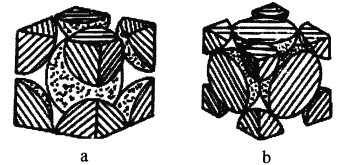
在图a所示堆积方式里铁原子的半径为rpm,则其晶胞棱长为_________cm。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为_________(用含圆周率π的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,继续滴加至液溴滴完.装置c的作用是_________,三颈烧瓶中反应的化学方程式为_____________________;

(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是__________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为____________,要进一步提纯,下列操作中必须的是_________________;(填入正确选项前的字母)
A.结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是____________。(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com