
【题目】根据题意解答
(1)已知ClO2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒.实验室制备ClO2是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2═2ClO2+2NaCl,装置如图所示: 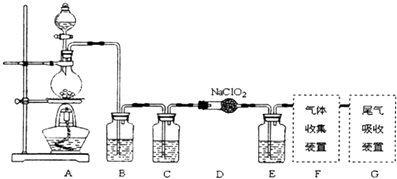
(i)烧瓶内可发生的反应的化学方程式: .
(ii)B,C,E装置中的试剂依次为
a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水
(iii)以下装置既能吸收尾气又能防止倒吸的是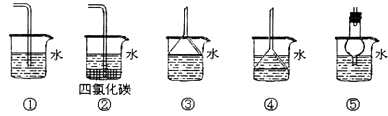
(2)用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mgL﹣1之间.用碘量法检测水中ClO2浓度的实验步骤如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10﹣4molL﹣1的Na2S2O3溶液滴定(己知:2S2O32﹣+I2═S4O62﹣+2I﹣). (i)加入的指示剂是 , 达到滴定终点时的现象是
(ii)碘化钾反应的离子方程式是
(iii)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中ClO2的浓度是mgL﹣1 .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;c、b、d;②③⑤
MnCl2+Cl2↑+2H2O;c、b、d;②③⑤
(2)淀粉溶液;滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色;2ClO2+8H++10I﹣=2Cl﹣+4H2O+5I2;0.22
【解析】解:(1)(i)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2 , 浓盐酸盛装在分液漏斗中,烧瓶内为MnO2 , 浓盐酸和MnO2在加热条件下反应生成二氯化锰、氯气、水,反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O, 所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O, 所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(ii)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2 , 所以B、C、E装置中的试剂依次为:饱和食盐水、浓硫酸、CCl4 ,
MnCl2+Cl2↑+2H2O;(ii)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2 , 所以B、C、E装置中的试剂依次为:饱和食盐水、浓硫酸、CCl4 ,
所以答案是:c、b、d;(iii)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,③⑤符合,②CCl4液体能缓冲起防倒吸作用,
所以答案是:②③⑤;
·(2)(i)根据题意发生反应:2ClO2+8H++10I﹣=2Cl﹣+4H2O+5I2 , 2S2O32﹣+I2═S4O62﹣+2I﹣可知,滴定过程中出现了碘单质,碘与淀粉变蓝,故选淀粉做指示剂,滴定到终点时,碘单质正好反应完,故滴定达到终点时溶液的颜色变化为溶液蓝色褪去,且30秒内不恢复蓝色,
所以答案是:淀粉溶液,滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色;(ii)用I﹣将溶液中的ClO2还原为Cl﹣以测定水样中C1O2的浓度,则I﹣被氧化为I2 , 氯从+4价降为﹣1价,碘离子从﹣1价被氧化为0价,故该反应的离子方程式为2ClO2+8H++10I﹣=2Cl﹣+4H2O+5I2 ,
所以答案是:2ClO2+8H++10I﹣=2Cl﹣+4H2O+5I2;
(iii)根据题意发生反应:2ClO2+8H++10I﹣=2Cl﹣+4H2O+5I2 , 2S2O32﹣+I2═S4O62﹣+2I﹣可知,
2ClO2 | ~ | 10I﹣ | ~ | 10S2O32﹣ |
2 | 10 | |||
3.26×10﹣7mol | 1.0×10﹣4 mol/L×0.01630L |
100mL的水样中m(ClO2)=n(ClO2)×M(ClO2)=3.26×10﹣7mol×67.5×103mgmol﹣1≈0.022mg,则水样中C1O2的浓度是0.22mgL﹣1 ,
所以答案是:0.22.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】一定量MgO和Al2O3的混合物投入250mL 2molL﹣1的盐酸中,充分反应后无固体剩余,再向反应后的溶液中加入1molL﹣1NaOH溶液,要使镁、铝元素恰好完全沉淀下来,需加入NaOH溶液( )
A.450mL
B.500mL
C.400mL
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护
B.用铜作电极电解稀硫酸,发生反应:Cu+H2SO4 ![]() CuSO4+H2↑
CuSO4+H2↑
C.某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D.某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双安妥明结构简式如图所示 ![]() ,可用于降低血液中的胆固醇,该物质合成线路如图所示:
,可用于降低血液中的胆固醇,该物质合成线路如图所示: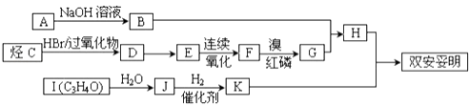
已知:Ⅰ. ![]()
Ⅱ.RCH═CH2 ![]() RCH2CH2Br
RCH2CH2Br
Ⅲ.已知:C的密度是同温同压下H2密度的28倍,且支链有一个甲基;I能发生银镜反应且1mol I(C3H4O)能与2mol H2发生加成反应;K的结构具有对称性.试回答下列问题:
(1)写出双安妥明的分子式 .
(2)C的结构简式为;H的结构简式为 .
(3)反应D→E的反应条件是 , 反应I→J的类型是 .
(4)反应“H+K→双安妥明”的化学方程式为 .
(5)符合下列3个条件的H的同分异构体有种.①与FeCl3溶液显色;②苯环上只有两个取代基;③1mol该物质最多消耗3mol NaOH,其中氢原子共有五种不同环境的是(写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是( )
A.H+、Ca2+、NO3-、CO32-B.K+、Na+、Br-、NO3-
C.Ag+、Na+、Cl-、K+D.NH4+、K+、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2、O2 混合气体共20g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是()
A. 40% B. 33% C. 60% D. 36%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有氧元素的化合物一定是氧化物
B. 纯净物一定由同种分子构成
C. 含一种元素的物质一定是单质
D. 由同种分子构成的物质一定是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是:
A. 元素的单质可由氧化或还原含该元素的化合物来制得
B. 得电子越多的氧化剂,其氧化性就越强
C. 阳离子只能得到电子被还原,只能作氧化剂
D. 含有高价元素的化合物,一定具有强的氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com