
【题目】下列关于物质性质的比较,不正确的是
A.非金属性强弱:I>Br>ClB.原子半径大小:Na>P>S
C.氧化性强弱:F2>Cl2>Br2D.金属性强弱:Na>Mg>Al
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. [Ne]3s2表示的是Mg原子
B. 3p2表示第三能层有2个电子
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 2p、3p、4p能级容纳的最多电子数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子半径最小的是( )
A. 1s22s22p3 B. 1s22s22p33s23p3
C. 1s22s22p5 D. 1s22s22p33s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是:
A.K2CO3和K2O都属于盐B.KOH和Na2CO3都属于碱
C.H2SO4和HNO3都属于酸D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
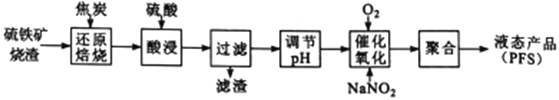
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
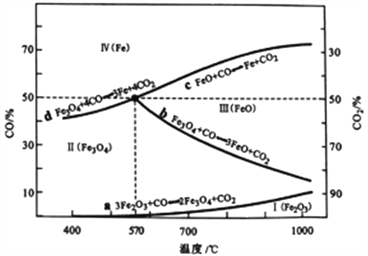
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________。
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________。
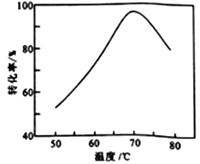
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求写出方程式:
①HNO3 (电离方程式)_____
②Fe2(SO4)3 (电离方程式)_____
③硫酸钠和氯化钡溶液反应(离子方程式)____
④二氧化碳通入足量氢氧化钠溶液(离子方程式)____________
(2)①0.4molCH4分子中所含原子数与__g HCl分子中所含原子数相等,该HC1气体在标准状况下的体积为________ L;
②等物质的量O2和臭氧(O3),其质量之比为_______;若O2和O3质量相等,则其原子数之比为__。
(3)以下为中学化学中常见的几种物质:①二氧化碳②熔融KC1③NaHSO4固体④铜⑤稀硫酸⑥澄清石灰水,其中属于电解质的有_____,属于非电解质的有____(填编号)。
(4)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取: 2Fe (OH) 3 + 4NaOH + 3NaC1O = 2Na2FeO4 + 3NaCl + 5H2O
①该反应中氧化剂是_________(用化学式表示,后同),______元素被氧化,还原物为__________ ;
②用单线桥在方程式中标出电子转移的情况:_______________
③当反应中有lmolNaFeO4生成,转移的电子有_________ mol;
④实验室欲配制250mL0.1 molL-1NaOH溶液,除烧杯、玻璃棒、量筒、胶头滴管,还需要用到的玻璃仪器为__________,下列操作配制的溶液浓度偏低的是__________。
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com