
【题目】下列说法正确的是
A.常温下,向0.1 mol·L1 CH3COONa中加入少量水,溶液中![]() 比值减小
比值减小
B.用0.1 mol·L1 NaOH溶液分别中和等体积等pH的盐酸和醋酸,盐酸消耗NaOH溶液的体积大
C.常温下,pH=10的氨水中,由水电离出的OH-浓度为1×10-4mol·L1
D.常温下,向10 mL pH=2的盐酸中分别加入V1 mL的水和V2 mL pH=12的NaOH溶液,所得溶液的pH均为3,忽略混合时溶液体积的变化,则V1∶V2=11∶1
【答案】D
【解析】
A. 加水促进CH3COO-的水解;
B. 等pH的盐酸和醋酸,醋酸的浓度大于盐酸的浓度;
C. 常温下,pH=10的氨水中,由水电离出的H+浓度为![]() =10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等;
=10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等;
D. 盐酸中c(H+)为0.01mol/L,加水稀释,溶质的物质的量不变,加入氢氧化钠溶液后根据混合后溶液的pH为3计算出需要氢氧化钠的体积,进一步进行计算。
A. 加水促进CH3COO-的水解,溶液中![]() 比值增大,A项错误;
比值增大,A项错误;
B. 等pH的盐酸和醋酸,醋酸的浓度大于盐酸的浓度,因此用0.1 mol·L1 NaOH溶液分别中和等体积等pH的盐酸和醋酸,醋酸消耗NaOH溶液的体积大,B项错误;
C. 常温下,pH=10的氨水中,由水电离出的H+浓度为![]() =10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等,即由水电离出的OH-浓度为10-3mol/L,C项错误;
=10-3mol/L,由水电离出的H+浓度与由水电离出的OH-浓度相等,即由水电离出的OH-浓度为10-3mol/L,C项错误;
D. 常温下,向10 mL pH=2的盐酸中加入V1 mL的水,c(H+)=![]() =10-3mol/L,解得V1=90ml;向10 mL pH=2的盐酸中加入V2 mL pH=12的NaOH溶液,混合后溶液pH为3,那么c(H+)=
=10-3mol/L,解得V1=90ml;向10 mL pH=2的盐酸中加入V2 mL pH=12的NaOH溶液,混合后溶液pH为3,那么c(H+)=![]() =10-3mol/L,解得V2=
=10-3mol/L,解得V2=![]() ml,因此V1∶V2=11∶1,D项正确;
ml,因此V1∶V2=11∶1,D项正确;
答案选D。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2L氯仿所含分子数为0.5NA
D.32g甲醇中含有C—H键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由实验得出的结论正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 甲烷与氯气以体枳比1:1混合在光照下反应生成油状物质 | 油状物质为一氯甲烷 |
B | 将苯加入溴水中,振荡,溴水层为无色 | 苯与Br2发生了加成反应 |
C | 碳酸钠溶液中加入乙酸产生气泡 | 乙酸酸性强于碳酸 |
D | 加热乙醇、冰醋酸及浓硫酸的混合液,有果香味物质生成 | 乙醇与冰醋酸发生了加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3B.Fe
无水AlCl3B.Fe![]() Fe2O3
Fe2O3![]() Fe(OH)3
Fe(OH)3
C.NH4Cl![]() NH3
NH3![]() NOD.稀盐酸
NOD.稀盐酸![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中充入2a(a>0)molH2和a mol CO,在一定条件下合成甲醇,CO(g)+2H2(g)CH3OH(g),达到平衡时容器内气体压强是起始时的0.6倍。
①在该温度下,平衡常数K=____ (用代数式表示)。
②在该温度下,向此平衡体系中加入a mol CH3OH(g),再次达到平衡后CO的体积分数将____(填“增大”“减小”或“不变”)
③下列情况表明反应达到平衡状态的是____
A.![]() 不再改变
不再改变
B.CO的消耗速率等于CH3OH的生成速率
C.混合气体的密度不再改变
D.混合气体的平均摩尔质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图像所得结论正确的是

A.图甲是反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0中SO2的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且Y1>Y2
2SO3(g) ΔH<0中SO2的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且Y1>Y2
B.图乙是室温下用0.1000 mol·L-1的一元酸HA滴定20.00 mL 0.1000 mol·L-1的一元碱BOH的滴定曲线,说明BOH是强碱
C.图丙是室温下稀释冰醋酸时溶液的导电能力随加入水的体积的变化曲线,说明醋酸的电离程度:b>a>c
D.图丁是室温下稀释相同体积、相同pH的稀盐酸和稀醋酸时溶液的pH随加入水的体积的变化曲线,说明曲线M代表的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某血液样品中钙离子的含量,可取该样品2.00mL用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用1.000×10-4molL-1酸性KMnO4标准溶液滴定,到达终点时用去20.00mL标准液。则下列说法中错误的是( )
A.用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B.KMnO4标准溶液应用碱式滴定管盛装
C.滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色
D.经计算该样品中钙离子浓度为1.000×10-4gmL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
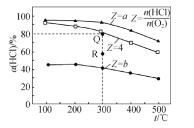
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com