
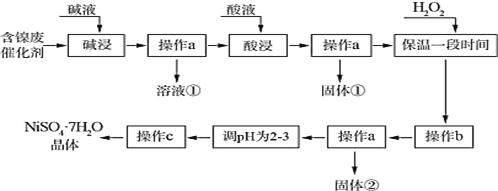
【题目】七水合硫酸镍为水绿色斜方棱形晶体,有甜味,俗称“翠矾”。某学习小组用含镍催化剂废渣(主要成分是镍单质,含少量铁、铝单质及其氧化物,以及少量难溶性杂质),制备七水合硫酸镍晶体,流程图如下:
几种难溶碱开始沉淀和完全沉淀的 pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀 | 3.8 | 2.7 | 7.6 | 7.1 |
完全沉淀 | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)“碱浸”操作发生的离子方程式为____________。
(2)①“固体①”的主要成分是__________,双氧水作用为___________。
②如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是_______________________,设计实验证明产品中是否含“杂质”:____________。(不考虑硫酸镍影响)
(3) “操作 b”中调节溶液 pH 范围是_________,“操作 c”之前,“调节 pH 为 2~3”的目的是_______。
(4) “操作 c”具体是指___________________、过滤、洗涤、干燥。
(5)取 4.000 g 硫酸镍晶体产品(NiSO4·7H2O)于锥形瓶中,加入足量的去离子水溶解,用0.2000 mol·L-1 的标准溶液EDTA(Na2H2Y)滴定至终点(发生Ni2++ H2Y2- = NiY2-+ 2H+ ),三次实验消耗标准液的体积分别为 69.10 mL、68.90 mL、59.00 mL,则产品纯度为_________%。(计算结果保留到小数点后 2 位,不考虑杂质反应)。
【答案】2A1 + 2OH- + 2H2O=2A1O2- + 3H2↑、Al2O3 +2OH- =2A1O2- + H2O 难溶性杂质 将Fe2+氧化为Fe3+,且不引入新杂质 产品中混有绿矾(FeSO4·7H2O ) 取少量样品加入蒸馏水溶解,滴加铁氰化钾溶液,产生蓝色沉淀,则产品中含有Fe2+ 3.2≤pH<7.1 抑制Ni2+水解 蒸发浓缩、冷却结晶 96.95
【解析】
镍催化剂废渣(主要成分是镍单质,含少量铁、铝单质及其氧化物,以及少量难溶性杂质)碱浸,铝单质及其氧化物溶解生成偏铝酸钠,过滤后所得溶液①的成分为NaAlO2;滤渣中含有镍单质、铁及其氧化物、难溶性杂质;酸浸后镍、铁及其氧化物溶解生成硫酸镍、硫酸铁及硫酸亚铁;过滤后所得固体①为难溶性杂质,滤液中加入H2O2将Fe2+完全氧化为Fe3+,然后调节pH将Fe3+生成Fe(OH)3,但不能让Ni2+生成沉淀,过滤所得固体②的成分为Fe(OH)3;然后再调节pH,也就是增大溶液的酸性,防止Ni2+水解生成Ni(OH)2沉淀,再蒸发结晶便可获得NiSO4·7H2O晶体。
(1)铝单质及其氧化物溶解生成偏铝酸钠,“碱浸”操作发生的离子方程式为2A1 + 2OH- + 2H2O=2A1O2- + 3H2↑、Al2O3 +2OH- =2A1O2- + H2O;答案为:2A1 + 2OH- + 2H2O=2A1O2- + 3H2↑、Al2O3 +2OH- =2A1O2- + H2O;
(2)①由以上分析知,“固体①”的主要成分是难溶性杂质;滤液中加入H2O2是为了将Fe2+转化为Fe3+,所以双氧水的作用为:将Fe2+氧化为Fe3+,且不引入新杂质;答案为:难溶性杂质;将Fe2+氧化为Fe3+,且不引入新杂质;
②如果加入双氧水量不足或“保温时间较短”,则Fe2+有一部分未被氧化为Fe3+,对实验结果的影响是产品中混有绿矾(FeSO4·7H2O),证明产品中是否含“杂质”,即检验Fe2+的存在,设计实验为:取少量样品加入蒸馏水溶解,滴加铁氰化钾溶液,产生蓝色沉淀,则产品中含有Fe2+;答案为:产品中混有绿矾(FeSO4·7H2O);取少量样品加入蒸馏水溶解,滴加铁氰化钾溶液,产生蓝色沉淀,则产品中含有Fe2+;
(3) “操作 b”中调节溶液 pH,应让Fe3+完全转化为Fe(OH)3沉淀,但不能让Ni2+生成沉淀,其范围是3.2≤pH<7.1;由以上分析知,“操作 c”之前,“调节 pH 为 2~3”的目的是抑制Ni2+水解。答案为:3.2≤pH<7.1;抑制Ni2+水解;
(4)从溶液中提取溶质,应进行蒸发结晶,所以 “操作 c”具体是指蒸发浓缩、冷却结晶、过滤、洗涤、干燥;答案为:蒸发浓缩、冷却结晶;
(5)三次实验消耗标准液的体积分别为69.10mL、68.90mL、59.00mL,其中59.00mL偏差太大,应舍去,然后计算69.10mL、68.90 mL的平均值为69.00 mL。
从反应方程式看,Ni2+—H2Y2-—NiSO4·7H2O,从而得出产品纯度为![]() =96.95%;答案为:96.95。
=96.95%;答案为:96.95。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.100g质量分数为17%的H2O2水溶液中含氧原子数目为NA
B.0.1molH2(g)与0.1molI2(g)于密闭容器中充分反应生成HI(g)后,其分子总数小于0.2NA
C.8.0gCH4与足量Cl2在光照下反应生成的HCl分子数最多为2NA
D.标准状况下,将54g铝片投入足量冷的浓硝酸中生成134.4LNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)MnO2在反应中____电子(填“得到”或“失去”),所含元素化合价______(填“升高”或“降低”),发生_____反应(填“氧化”或“还原”)。
(2)HCl在反应中_____电子(填“得到”或“失去”),所含元素化合价_____(填“升高”或“降低”),发生____反应(填“氧化”或“还原”)。
(3)该反应中氧化剂是___;还原剂是____;氧化产物是___ ;还原产物是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
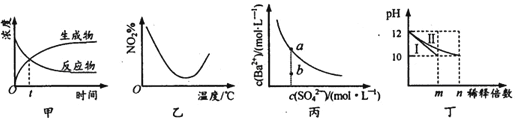
A. 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B. 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O
C. 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D. 图丁表示分别稀释l0mLpH均为12的NaOH和NH3·H2O溶液时pH的变化,曲线I表示NH3 H2O溶液,n>100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化合物YX2和ZX2中,已知X、Y、Z都是前三周期的元素,X与Y同周期,Y与Z同主族,Y原子的最外层电子数是次外层电子数的2倍;X原子最外层上有6个电子。根据以上条件,回答问题:
(1)Y的原子结构示意图为___。
(2)YX2的结构式是___,分子内的共价键是___(填“极性键”或“非极性键”)。
(3)ZX2的化学式为___。
(4)用电子式表示YX2的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备。回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为___。
(2)与BC13分子互为等电子体的一种离子为___(填化学式)。
(3)PH3分子的立体结构为___;PH3的沸点___(填“高于”或“低于”)NH3,理由是___。
(4)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为___。
(5)BCl3可转化为硼酸,硼酸为一元强酸的原因是___(用离子方程式表示)。
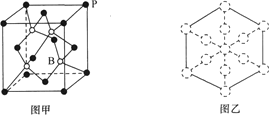
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为___。已知磷化硼晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则晶胞中B原子与P原子间最短距离为___pm。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置___(注意原子体积的相对大小)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Na+、Fe2+、Cl–、NO3–等离子能在甲基橙试液显红色的溶液中共存
B. 电解熔融的氧化铝制取金属铝,用铁作阳极
C. NaHS水解的离子方程式为:HS–+H2O ![]() S2–+H3O+
S2–+H3O+
D. NaHCO3的电离方程式为:NaHCO3=Na++HCO3–,HCO3– ![]() H++CO32–
H++CO32–
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com