
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制备NaClO2的工艺流程如下图所示:

下列说法不正确的是
A. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
B. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
C. 吸收器中生成 NaClO2的离子方程式:2ClO2+H2O2=2ClO2-+O2↑+2H+
D. 步骤a的操作包括过滤、洗涤和干燥
科目:高中化学 来源: 题型:
【题目】某一条肽链由10个氨基酸组成,利用水解法I可得到四个片段,即:A-P;H-V;G-L-B-T;C-T.利用水解法Ⅱ可得到三个片段,即:A-P-G-L;T-H-V;B-T-C.(其中字母表示氨基酸,“-”表示肽键)。从有重叠结构的各个肽的顺序中可推断出该十肽的氨基酸序列为( )
A. A-P-H-V-G-L-B-T-C-TB. A-P-G-L-B-T-C-T-H-V
C. T-H-V-A-P-G-L-B-T-CD. G-L-B-T-A-P-H-V-C-T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如图:

(1)写出反应I的离子方程式________________________。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有__________。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3 mol·L-1)可产生FeCO3沉淀时的最小Fe2+浓度是_________。(已知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式________________________________________。
(5)固体物质A的成分是_________(写名称),溶液B中所含溶质是__________(写化学式)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红褐色的Fe(OH)3固体,写出相关的化学方程式:_____________________________________________。
(7)本流程中可实现循环使用的物质除了水外,还有____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0,下列有关该平衡体系的说法正确的是( )
Ca2+(aq)+2OH-(aq) △H<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③恒温下向溶液中加入CaO,溶液的pH升高
④加热溶液,溶液的pH升高
⑤向溶液中加人Na2CO3溶液,其中固体质量增加
⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A. 仅①⑤ B. 仅①⑤⑥ C. 仅②③⑤ D. 仅①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硼元素对植物生长及人体健康有着十分重要的作用,硼的化合物被广泛应用于新材料制备、生活生产等诸多领域。
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
A.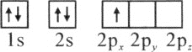
B.
C.
D.
(2)晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的________。
(3)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。
①H3BO3晶体中单元结构如图Ⅰ所示。各单元中的氧原子通过________氢键(用“A—B…C”表示,A、B、C表示原子)连结成层状结构,其片层结构如图Ⅱ所示,层与层之间以________(填作用力名称)相结合构成整个硼酸晶体。

②硼氢化钠中![]() 的键角大小是________,立体构型为________。
的键角大小是________,立体构型为________。
③根据上述结构判断下列说法正确的是________
a.H3BO3分子的稳定性与氢键有关
b.硼酸晶体有滑腻感,可作润滑剂
c.H3BO3分子中硼原子最外层为8e-稳定结构
d.含1mol H3BO3的晶体中有3 mol氢键
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是________;已知晶胞边长为a pm,则磷化硼晶体的密度是________g·cm-3(列出含a、NA的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
①浓H2SO4 ②NaOH溶液 ③饱和NaCl溶液

A.②B.①②C.②③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液A时,溶液的导电性的变化趋势如图(Ⅱ)所示。

(1)滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质可能是(填序号)__________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(2)已知0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式_______________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______;在以上中性溶液中,继续滴加Ba(OH)2溶液_______,
(3)用一种试剂除去下列各物质中的杂质(括号内的物质),写出所用的试剂及反应的离子方程式。
Ⅰ.CaCl2(HCl):试剂______(,离子方程式___________;
Ⅱ.O2(CO2):试剂______,离子方程式____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A. C2H5COOC2H5存在C4H9COOH时可以加入饱和Na2CO3溶液后分液除去
B. 异戊烷也叫2-甲基戊烷
C. 分子式为C5H12O且能与金属钠反应产生气体的有机物,其同分异构体共有9种
D. 不能用溴水鉴别苯、乙醇、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O![]() 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com