
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42﹣、和NO3﹣的相互分离.相应的实验过程可用下图表示:请回答下列问题: 
(1)写出实验流程中下列物质的化学式:试剂X , 沉淀A .
(2)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 .
(3)上述实验流程中加入过量的Na2CO3的目的是 , 确认Na2CO3已过量的实验方法是:
(4)写出步骤①中发生反应的离子方程式: .
【答案】
(1)BaCl2[或Ba(NO3)2];BaSO4
(2)Na2CO3;稀HNO3
(3)使溶液中的Ag+、Ba2+完全沉淀;静置取上清液继续滴加Na2CO3溶液,若无沉淀则证明Na2CO3过量
(4)Ba2++SO42﹣=BaSO4↓
【解析】解:含NaCl、Na2SO4和NaNO3的混合物,要实现Cl﹣、SO42﹣、和NO3﹣的相互分离,如先加入AgNO3 , 则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3 , 使Cl﹣全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3 , 使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3 , 最后进行蒸发操作可得固体NaNO3 , (1)根据上面的分析可知,试剂X为 BaCl2[或Ba(NO3)2],沉淀A为BaSO4 ,
所以答案是:BaCl2[或Ba(NO3)2];BaSO4;(2)在所得滤液中加入过量的Na2CO3 , 最后所得溶液为NaNO3和Na2CO3的混合物,为了解决这个问题,可以向溶液3中加入适量的稀HNO3 , 稀HNO3与Na2CO3反应生成NaNO3 , 所以答案是:Na2CO3;稀HNO3;(3)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3 , 使Cl﹣全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+ , 在所以在所得滤液中加入过量的Na2CO3 , 使溶液中的Ag+、Ba2+完全沉淀,确认Na2CO3已过量的实验方法是静置取上清液继续滴加Na2CO3溶液,若无沉淀则证明Na2CO3过量,所以答案是:使溶液中的Ag+、Ba2+完全沉淀;静置取上清液继续滴加Na2CO3溶液,若无沉淀则证明Na2CO3过量;(4)步骤①中加入的是BaCl2[或Ba(NO3)2],发生反应的离子方程式为Ba2++SO42﹣=BaSO4↓,所以答案是:Ba2++SO42﹣=BaSO4↓.


科目:高中化学 来源: 题型:
【题目】填空
(1)某元素原子的质量数为A,它的阴离子Xn﹣核外有x个电子,w克这种元素的原子核内中子的物质的量为mol
(2)在K2SO4和KCl的混合溶液中,K+的物质的量浓度为1.2mol/L,SO42﹣的物质的量浓度为0.4mol/L,则此溶液中Cl﹣的物质的量浓度为:
(3)写出二氧化氮与水的反应方程式 , 氧化剂与还原剂的物质的量比为 .
(4)从1L1molL﹣1NaCl溶液中取出200mL溶液,取出的溶液中NaCl的物质的量浓度是molL﹣1 , 取出的溶液中NaCl的物质的量是mol,质量是g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有机物CH3-CH═CH-Cl能否发生的反应及有关说法正确的是( )
①取代反应②加成反应③消去反应④使溴水褪色⑤使酸性KMnO4溶液褪色⑥与AgNO3溶液生成白色沉淀⑦聚合反应⑧该有机物不存在顺反异构体
A.以上均对B.只有⑥⑧不对
C.只有⑥不对D.只有②不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室中对以SO2的性质进行探究和物质制取.回答下列问题:
(1)① 学生甲以Na2SO3粉未和70% H2SO4为原料制取SO2,下图装置A中仪器X的名称是____;用较浓的硫酸而不用稀硫酸,其原因是________________。
② 现欲收集一瓶干燥的SO2,选择图16,中的装置,其连接顺序为________(按气流方向,用小写字母表示)。

(2)学生乙用浓H2SO4和乙醇反应得到的乙烯气体中含有SO2、CO2。现选择下图中的装置,检验混合气体中存在乙烯和SO2,则装置中盛放的试剂是A______,B______,C______,D______。

(3)Cu2SO3·CuSO3·2H2O是一种深红色固体,不溶于水和乙醇,100℃时发生分解,其制备实验装置如图 所示。
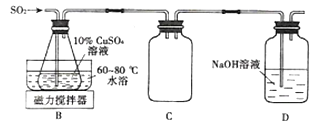
①装置C的作用是______________。
②装置B中发生反应的离子方程式为_______________。
③从装置B中获得的固体需先用蒸馏水充分洗涤,再真空干燥,而不直接用烘干的方式得到产品,其原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: 
(1)该浓盐酸中HCl的物质的量浓度为molL﹣1 .
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL 物质的量浓度为0.400molL﹣1的稀盐酸.
①该学生需要量取mL 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对配制的稀盐酸的物质的量浓度偏小的是
A.用量筒量取浓盐酸进俯视观察凹液面
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度将
D.定容时,眼睛俯视
E.未冷却到室温就注入容量瓶定容
③配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com