
【题目】常温下,向25.00mL 0.1mol·L-1 HSCN溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法正确的是( )

A. 常温下,Ka(HSCN)约为1×10-3
B. N点溶液中:c(Na+)<c(SCN-)
C. R、Q两点溶液对应的[H+]都为10-7
D. b=25.00
【答案】D
【解析】
A. 根据题图知,0.1mol·L-1 HSCN溶液中-1gc水(H+)=11,则c水(H+)=10-11mol/L,故溶液中c(H+)=10-3mol/L,则Ka(HSCN)=![]() =1×10-5,故A错误;
=1×10-5,故A错误;
B. -1gc水(H+)越小,水的电离出的越大。N点是水的电离程度最大的点,此时溶液是NaSCN溶液,酸与碱恰好反应,SCN-水解,则所得溶液呈碱性,c(OH-)>c(H+),根据电荷守恒可知c(Na+)+c(H+)=c(SCN-)+c(OH-),则c(Na+)>c(SCN-),故B错误。
C. R点为HSCN和NaSCN的混合溶液,HSCN的电离程度等于SCN-的水解程度,溶液呈中性,而Q时-1gc水(H+)=7,Q点的溶液为NaSCN和NaOH的混合溶液,溶液呈碱性,因此R、Q两点溶液中对应的氢离子浓度不相等,故C错误;
D. -1gc水(H+)越小,水的电离出的越大。N点是水的电离程度最大的点,此时溶液是NaSCN溶液,酸与碱恰好反应,则b=25.00,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为![]() ,关于该有机物下列叙述正确的是
,关于该有机物下列叙述正确的是
A. 不能使酸性高锰酸钾溶液褪色
B. 不能使溴水褪色
C. 在加热和催化剂作用下,最多能和4mol H2反应
D. 一定条件下,能和NaOH醇溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50mL0.55molL-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是 ______ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H= ______ (结果保留一位小数)。
(3) ______(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
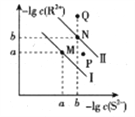
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是核电荷数依次增大的六种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置______________________________________________
(2)F元素的最高价氧化物对应的水化物的化学式为___________________________________。
(3)元素C、D、E形成的简单离子半径由小到大的顺序________________________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:__________________________________________________。
C、D还可形成化合物D2C2,D2C2中含有的化学键是_________________________________________。
(5)C、E的氢化物,沸点由高到低顺序是:_______________________________。
(6)写出碳单质与E的最高价氧化物对应水化物浓溶液反应的化学方程式,并用单线桥标明电子的转移方向_______________。当转移电子为0.2mol时,标准状况下反应产生气体_______________L。
(7)已知E单质和F单质的水溶液反应会生成两种强酸,其离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为 31 的元素 R,在周期表中的位置为
A.第三周期第VA族B.第四周期第IIIA 族
C.第五周期第IIIA 族D.第四周期第VA 族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com