
【题目】有机化合物与我们的生活息息相关。下列说法正确的是
A. 卤代烃C3H7Cl有三种同分异构体
B. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
C. 棉花和合成纤维的主要成分都是纤维素
D. 结构简式如图所示的有机物能发生加成反应、取代反应、氧化反应

【答案】D
【解析】
A.C3H8只有一种结构:CH3CH3CH3,分子中只有2种氢原子;
B.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量;
C.合成纤维是有机合成高分子材料;
D.由结构简式可知,分子中含碳碳双键、酯基。
A. C3H8只有一种结构:CH3CH2CH3,分子中只有2种氢原子,则卤代烃C3H7Cl有2种同分异构体,A项错误;
B..石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,B项错误;
C..合成纤维是有机合成高分子材料,而棉花的主要成分是纤维素,C项错误;
D..由结构简式可知,分子中含碳碳双键可发生加成、氧化反应,含有酯基可以在碱性或酸性条件下发生水解反应,水解反应属于取代反应,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若平衡体系A+B![]() C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )
C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )

A.A、B、C、D都是气体
B.C、D都是气体,A、B中有一种是气体
C.A、B都不是气体,C、D中有一种是气体
D.A、B都是气体,C、D中有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
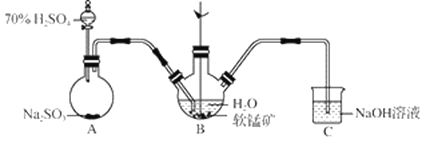
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
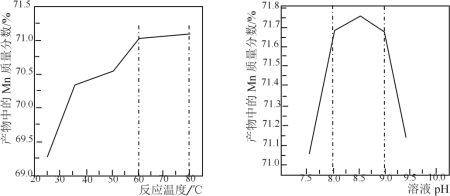
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-→ZnO+H2O,Ag2O+H2O+2e-→2Ag+2OH-。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是( )
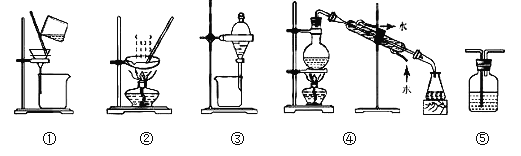
A. 用图①和②所示装置进行粗盐提纯
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图④所示装置进行石油分馏实验制取汽油
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中充入2molA和1molB发生反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
A. 2 B. 3 C. 2或3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是( )

A. K与M、N均断开,一段时间后电解质溶液质量变大
B. K分别与M、N相连时,铁均受到保护
C. K与M相连时,每转移1mol电子Fe表面生成32gCu
D. K与N相连时, 碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是某种药物的中间体,其结构简式如图,关于有机物A的说法正确的是
![]()
A. A既可发生氧化反应,又可发生加成反应
B. A可使酸性KMnO4溶液褪色,不可使溴的CCl4溶液褪色
C. A苯环上的一氯代物同分异构体有2种
D. A的分子式为C16H16O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com