
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
【答案】K12/K2 289-2a 2 4×10-8 L/(mol·s) 40% 5/p A D
【解析】
(1)①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) 的平衡常数K1=
NaNO3(s)+ClNO(g) 的平衡常数K1=![]() ,② 2NO(g)+Cl2(g)
,② 2NO(g)+Cl2(g)![]() 2ClNO(g)的平衡常数K2=
2ClNO(g)的平衡常数K2=![]() ;(2)焓变=反应物的总键能-生成物的总键能;(3)将
;(2)焓变=反应物的总键能-生成物的总键能;(3)将![]() 得n,将n代入①中得k;(4)①NO的体积分数即物质的量分数,利用“三段式”计算平衡后NO的物质的量分数;分压=总压
得n,将n代入①中得k;(4)①NO的体积分数即物质的量分数,利用“三段式”计算平衡后NO的物质的量分数;分压=总压![]() 体积分数,则NO、Cl2、ClNO的分压强分别是
体积分数,则NO、Cl2、ClNO的分压强分别是![]() 、
、![]() 、
、![]() ;(5)NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=1.5时较C点NO的物质的量大,平衡右移,产物的含量增大。
;(5)NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=1.5时较C点NO的物质的量大,平衡右移,产物的含量增大。
(1)①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)平衡常数K1=![]() ,②2NO(g)+Cl2(g)
,②2NO(g)+Cl2(g)![]() 2ClNO(g)平衡常数K2=
2ClNO(g)平衡常数K2=![]() ,则4NO2(g)+2NaCl(s)
,则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)可由2×①-②得到,所以K= K12/ K2;(2)2NO(g)+Cl2(g)2ClNO(g)的ΔH=
2NaNO3(s)+2NO(g)+Cl2(g)可由2×①-②得到,所以K= K12/ K2;(2)2NO(g)+Cl2(g)2ClNO(g)的ΔH=![]() kJ/mol;(3)υ正=kcn(ClNO),则
kJ/mol;(3)υ正=kcn(ClNO),则![]() ,解得n=2;将n代入①中得
,解得n=2;将n代入①中得![]() ,解得k=4.0×10-8L/(mo1s);(4)①设反应前氯气的物质的量是amol,则n(NO)=2amol
,解得k=4.0×10-8L/(mo1s);(4)①设反应前氯气的物质的量是amol,则n(NO)=2amol
2NO(g)+Cl2(g)2ClNO(g)
初始 2a a 0
变化 a 0.5a a
平衡 a 0.5a a
在p压强条件下,M点时容器内NO的体积分数为![]() = 40%;
= 40%;
②NO、Cl2、ClNO的分压强分别是![]() 、
、![]() 、
、![]() ,Kp=
,Kp=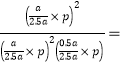 5/p ;(5)NO的物质的量越大其转化率越小,所以NO转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大;当n(NO)/n(Cl2)=1.5时较C点NO的物质的量大,平衡右移,产物的含量增大,应为D点;
5/p ;(5)NO的物质的量越大其转化率越小,所以NO转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大;当n(NO)/n(Cl2)=1.5时较C点NO的物质的量大,平衡右移,产物的含量增大,应为D点;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所含有的质量。
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
(2)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为 ____。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均为正值)
下列说法正确的是
A. 1molR(g)的能量总和大于1molM(s)与1molN(g)的能量总和
B. 将2mol R(g)与1molN(g)充分混合,在一定条件下充分反应,放出热量Q2 kJ
C. 当1molM(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,则Q3 < Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下(T1 <T2),可逆反应2X(g) ![]() 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(1)PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子(OH-忽略不计)的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
则试样的pH为________________________。
(2)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:

①该可逆反应的ΔH__________0(填“>”“<”或“=”)。A、B、C三点对应的平衡常数KA、KB、KC的大小关系是______________。压强:p1__________p2(填“>”“<”或“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_________(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2 mol CO和4 mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2 L,则在该条件下反应的平衡常数K为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为__________ mol,其中CO2为__________mol,CO占总体积的__________,混合气体的摩尔质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2 mol NH3,经过一段时间达平衡后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为
A. 25% B. 80% C. 10% D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与我们的生活息息相关。下列说法正确的是
A. 卤代烃C3H7Cl有三种同分异构体
B. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
C. 棉花和合成纤维的主要成分都是纤维素
D. 结构简式如图所示的有机物能发生加成反应、取代反应、氧化反应

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com