
【题目】防治雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(1)PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子(OH-忽略不计)的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
则试样的pH为________________________。
(2)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:

①该可逆反应的ΔH__________0(填“>”“<”或“=”)。A、B、C三点对应的平衡常数KA、KB、KC的大小关系是______________。压强:p1__________p2(填“>”“<”或“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_________(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2 mol CO和4 mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2 L,则在该条件下反应的平衡常数K为_________________________。
【答案】4 < KA=KB>KC < > AC 1 (L/mol)2
【解析】
(1)根据电荷守恒计算c(H+);(2)①根据图像可知,升高温度,CO的平衡转化率减小,平衡逆向移动;K只与温度有关,正反应放热,升高温度平衡逆向移动,平衡常数减小;CO(g)+2H2(g) CH3OH(g),正反应气体物质的量减少,增大压强平衡正向移动,CO转化率增大;在T1条件下,由D点到B点过程中,CO转化率增大,反应正向进行;②当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些变量也不发生变化时,一定达到平衡状态。③在p2、T2条件下达到平衡状态C点,CO的平衡转化率为0.5,利用“三段式”计算平衡常数;
(1)根据电荷守恒,c(H+)= 2×3.5×10-5+6.0×10-5-2.0×10-6-2.8×10-5=1×10-4 mol/L,所以pH=4;(2)①根据图像可知,升高温度,CO的平衡转化率减小,平衡逆向移动,所以正反应放热,ΔH<0;K只与温度有关,A、B温度相同,所以KA=KB,正反应放热,升高温度平衡逆向移动,平衡常数减小,B![]() C温度升高,所以KB>KC,故KA=KB>KC;CO(g)+2H2(g) CH3OH(g),正反应气体物质的量减少,增大压强平衡正向移动,CO转化率增大,
C温度升高,所以KB>KC,故KA=KB>KC;CO(g)+2H2(g) CH3OH(g),正反应气体物质的量减少,增大压强平衡正向移动,CO转化率增大,![]() 温度下,B点转化率大于A,所以B压强大于A,p1<p2;在T1条件下,由D点到B点过程中,CO转化率增大,反应正向进行,所以v(正)>v(逆);②反应过程中CO的体积分数是变量,当CO的体积分数保持不变时,一定达到平衡状态,故选A;根据
温度下,B点转化率大于A,所以B压强大于A,p1<p2;在T1条件下,由D点到B点过程中,CO转化率增大,反应正向进行,所以v(正)>v(逆);②反应过程中CO的体积分数是变量,当CO的体积分数保持不变时,一定达到平衡状态,故选A;根据![]() ,反应过程中密度是恒量,容器内混合气体的密度保持不变,不一定平衡,故不选B;根据
,反应过程中密度是恒量,容器内混合气体的密度保持不变,不一定平衡,故不选B;根据![]() ,反应过程中,气体物质的量是变量,所以平均摩尔质量是变量,容器内混合气体的平均摩尔质量保持不变,一定平衡,故选C;单位时间内消耗CO的浓度等于生成CH3OH的浓度,都是正反应速率,不一定平衡,故不选D。③在p2、T2条件下达到平衡状态C点,CO的平衡转化率为0.5,
,反应过程中,气体物质的量是变量,所以平均摩尔质量是变量,容器内混合气体的平均摩尔质量保持不变,一定平衡,故选C;单位时间内消耗CO的浓度等于生成CH3OH的浓度,都是正反应速率,不一定平衡,故不选D。③在p2、T2条件下达到平衡状态C点,CO的平衡转化率为0.5,
CO(g)+2H2(g) CH3OH(g)
开始 2mol 4mol 0
转化 1mol 2mol 1mol
平衡 1mol 2mol 1mol
![]() 1 (L/mol)2。
1 (L/mol)2。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成部分反应条件略去)
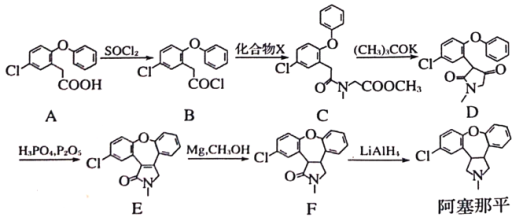
(1)阿塞那平中的含氧官能团名称为___________,由F→阿塞那平的反应类型为___________。物质A的分子式为___________。
(2)A生成B的过程中有SO2产生,写出A→B反应方程式______________________。
(3)化合物X的分子式为C4H9NO2,则X的结构简式为______________________。
(4)由D生成E的过程中先发生加成反应,后发生消去反应,加成反应后生成的中间体的结构简式为___________。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:__________________。
I属于芳香化合物,分子中含有5种不同化学环境的氢;
Ⅱ能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(6)参照上述合成流程,写出以CH3NH2和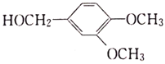 为原料制备
为原料制备 的合成流程(无机试剂任用)______________________。
的合成流程(无机试剂任用)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探讨反应A(g)+2B(g) ![]() 2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
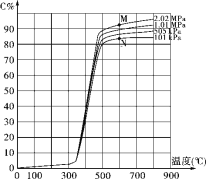
(1)该反应的反应热为ΔH_____0(填“>”、“<”或“=”)。
(2)点M和点N处平衡常数K的大小是:KM______KN(填“>”、“<”或“=”)。
(3)工业上进行该反应获得产品C的适宜条件是:度为______℃,选择该温度的理由是________________,压强为______,选择该压强的理由是__________________ 。
(4)试解释图中350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
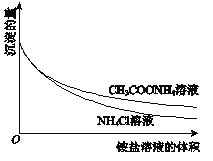
A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) ![]() 2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化的数值 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0)kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C. 容器②中反应达到平衡时放出的热量为Q kJ
D. 若容器①体积为 0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:
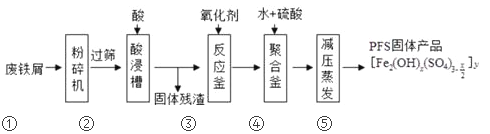
下列说法不正确的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
C. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
D. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期的元素,其原子序数依次增大,A为元素周期表中原子半径最小的元素,B的基态原子中占有电子的3个能级上的电子数均相等,D与B同族,C与B同周期,且C的所有p轨道上的电子数与所有s轨道上的电子数相等,E的次外层电子数是其最外层电子的7倍。
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为___________;(用元素符号表示),D元素基态原子价层电子排布式为______________________;
(2)A、C形成的三原子分子中,C原子的杂化方式为___________;
(3)C、D形成的化合物的晶体类型为___________;
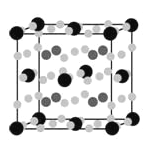
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:______________________。
(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。
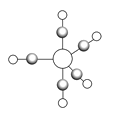
该配合物形成配位键时提供空轨道的原子是___________(填元素符号),该配合物中大白球代表的元素的化合价为___________。
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:______________________
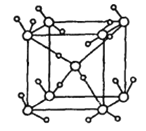
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-→ZnO+H2O,Ag2O+H2O+2e-→2Ag+2OH-。据此判断锌是( )
A.负极,并被氧化B.正极,并被还原
C.负极,并被还原D.正极,并被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com