
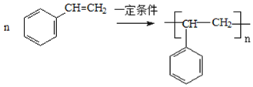
����Ŀ����ϩ����Ҫ�Ļ���ԭ�ϣ�����ϩΪԭ���ڲ�ͬ�����¿ɺϳ��������ʣ���������δ����������������գ�

(1)�Ҵ��������ᷴӦ�����й���ζ�����ʣ�������Ϊ_______���÷�Ӧ������_________��
(2)��Ӧ�Ļ�ѧ����ʽ�� _________________��ʵ�������� _____________��
(3)��Ӧ����KOH���Ҵ���Һ����������ϩ�ķ���ʽΪ ________��
(4)����ϩ�����������ŵ����� ____________________��
(5)����ϩ�ϳɾ۱���ϩ�Ļ�ѧ����ʽ�� _______________________��
(6)���Ҵ��ͱ���ϩΪԭ�Ϻϳ��л���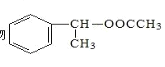 ��д���ϳ�·��ͼ��______
��д���ϳ�·��ͼ��______
�ϳ�·������ͼʵ�����£�
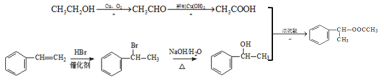
���𰸡��������� ������Ӧ��ȡ����Ӧ�� CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O��+2H2O ����ש��ɫ����
CH3COOH+Cu2O��+2H2O ����ש��ɫ���� ![]() ̼̼˫��
̼̼˫�� 
��������
��Ӧ������ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����Ӧ������ϩ�����������ӳɷ�Ӧ����1��2-�������飬��Ӧ����1��2-�������鷢����ȥ����Ӧ��������ϩ��HCl����Ӧ������ϩ�����Ӿ۷�Ӧ���ɾ���ϩ����Ӧ������ϩ�������ڴ��������·���������Ӧ������ȩ����Ӧ������ȩ������������ͭ����������Ӧ�����������ϩ�����Ӿ۷�Ӧ���ɾ۱���ϩ��
(6)![]() ����CH3COOH��
����CH3COOH��![]() ����������Ӧ�õ���
����������Ӧ�õ���![]() ����
����![]() ����ˮ�ⷴӦ�õ���
����ˮ�ⷴӦ�õ���![]() ����
����![]() ��HBr�����ӳɷ�Ӧ�õ���CH3COOH����CH3CHO����������Ӧ�õ���CH3CHO����CH3CH2OH����������Ӧ�õ���
��HBr�����ӳɷ�Ӧ�õ���CH3COOH����CH3CHO����������Ӧ�õ���CH3CHO����CH3CH2OH����������Ӧ�õ���
(1)�Ҵ��������ᷴӦ�����й���ζ�����ʣ�������Ϊ�����������÷�Ӧ������������Ӧ(ȡ����Ӧ)���ʴ�Ϊ������������������Ӧ(ȡ����Ӧ)��
(2)��Ӧ�Ļ�ѧ����ʽ��CH3CHO+2Cu(OH)2![]() Cu2O��+CH3COOH+2H2O��ʵ����������ש��ɫ�������ɣ��ʴ�Ϊ��CH3CHO+2Cu(OH)2
Cu2O��+CH3COOH+2H2O��ʵ����������ש��ɫ�������ɣ��ʴ�Ϊ��CH3CHO+2Cu(OH)2![]() Cu2O��+CH3COOH+2H2O����ש��ɫ�������ɣ�
Cu2O��+CH3COOH+2H2O����ש��ɫ�������ɣ�
(3)��Ӧ����KOH���Ҵ���Һ������������������ϩ�ķ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)����ϩ�����������ŵ�����̼̼˫�����ʴ�Ϊ��̼̼˫����
(5)����ϩ�ϳɾ۱���ϩ�Ļ�ѧ����ʽ��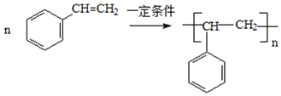 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(6)�Ҵ��ͱ���ϩΪԭ�Ϻϳ��л���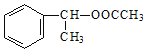 ��
��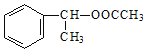 ����CH3COOH��
����CH3COOH��![]() ����������Ӧ�õ���
����������Ӧ�õ���![]() ����
����![]() ����ˮ�ⷴӦ�õ���
����ˮ�ⷴӦ�õ���![]() ����
����![]() ��HBr�����ӳɷ�Ӧ�õ���CH3COOH����CH3CHO����������Ӧ�õ���CH3CHO����CH3CH2OH����������Ӧ�õ�����ϳ�·��Ϊ
��HBr�����ӳɷ�Ӧ�õ���CH3COOH����CH3CHO����������Ӧ�õ���CH3CHO����CH3CH2OH����������Ӧ�õ�����ϳ�·��Ϊ 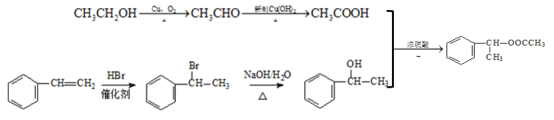
�ʴ�Ϊ�� ��
��


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���ͬpH�İ�ˮ������������Һ�ֱ��ˮϡ�ͣ���ҺpH����Һ����仯��������ͼ��ʾ����ͼ�ж���ȷ���ǣ� ��
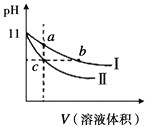
A.��Ϊ��ˮϡ��ʱ��pHֵ�仯����
B.a��b��c������Һ�ĵ����ԣ�c>b=a
C.a��b��c������Һ��ˮ�ĵ���̶ȣ�c=b>a
D.����ͬŨ�ȵ�����ֱ���������b��c����Һǡ����ȫ��Ӧ����������������Vb=Vc
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����һ���ϴ���������ֱû��ˮ�У�������ˮ�����������٣�һ��ʱ�����AB�β����϶����⣬BC�θ�ʴ���ء����й��ڴ������˵��������ǣ� ��
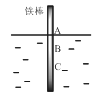
A.�ø�ʴ�������ڵ绯��ʴ
B.����AB�ε缫��ӦΪO2 + 2H2O+ 4e-�� 4OH��
C.����AB���Ǹ�����BC��������
D.����������ĸ���ԭ��������������ѧ�����IJ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú�����еĵ������NOx����CO2��SO2�����壬��Ҫ���ò�ͬ������������ʵ�ֽ��ܼ��š��������õȡ�
��1������Ϊ��������͵���������ת���IJ��ֻ��ڣ�
����֪��2SO2��g����O2��g��![]() 2SO3��g�� ��H����196.6 kJmol��1
2SO3��g�� ��H����196.6 kJmol��1
2NO��g����O2��g��![]() 2NO2��g�� ��H����113.0 kJ��mol��1
2NO2��g�� ��H����113.0 kJ��mol��1
��SO2������NO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽΪ_________��
��һ�������£���ҵ�Ͽ�ͨ�����з�Ӧʵ��ȼú������Һ̬��Ļ��գ�����Y�ǵ��ʣ�SO2��g����2CO��g�� ![]() 2X��g����Y��l����Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ�ij��ѧ��ȤС����ij�¶��¡��̶��������ó��������崫������ò�ͬʱ���SO2��COŨ�����±���
2X��g����Y��l����Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ�ij��ѧ��ȤС����ij�¶��¡��̶��������ó��������崫������ò�ͬʱ���SO2��COŨ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c��SO2��/mol��L��1 | 1.00 | 0.50 | 0.23 | 3.00��10��37 | 3.00��10��37 |
c��CO��/mol��L��1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X�Ļ�ѧʽΪ___________����ʱ��Ϊ��4 sʱ��2v��SO2����____������>������������<����v��X������
��2���п�ѧ�Ҿ����о����֣���210~290�桢������������H2�ɽ�CO2ת�����ɼ״�������ˮ������һ�������£���2 L�����ܱ������г���1 mol CO2��3. 0 mol H2���ڲ�ͬ���������£���ͬʱ����CO2��ת�������¶ȱ仯��ͼ��ʾ��

�ٴ���Ч����ѵ��Ǵ���
�ڴ˷�Ӧ��a��ʱ�Ѵ�ƽ��״̬��a���ת���ʱ�c��ߵ�ԭ����___________����֪�����ڵ���ʼѹǿΪ100 kPa����ͼ��c���Ӧ�¶��·�Ӧ��ƽ�ⳣ��Kp��______��������λ��Ч���֣���KpΪ�Է�ѹ��ʾ��ƽ�ⳣ���� ��ѹ����ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A~G�Ǽ��������ӵ����ģ��,�ݴ˻ش���������:
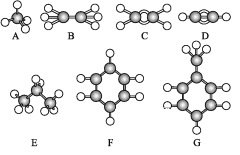
��1��������������:
�ٳ����º�̼����ߵ���̬����____����ṹ��ʽ����
���ܹ������ӳɷ�Ӧ������____�֡�
����A��Ϊͬϵ�����____�����Ӧ��ĸ����
��һ±��������������____�����Ӧ��ĸ����
��2��д��C�����Ӿ۷�Ӧ�Ļ�ѧ����ʽ:____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����ѧ������ȷ������ ��
A. NaHCO3ˮ������ӷ���ʽ��HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2�ĵ��뷽��ʽ��Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4��ˮ�еĵ��뷽��ʽ��NaHSO4= Na++H++SO42-
D. Na2Sˮ������ӷ���ʽ��S2-+2H2O = H2S+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ������˵������ȷ���ǣ� ��
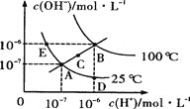
A.ͼ�����Kw��Ĺ�ϵB>C>A=D=E
B.����A�㵽D�㣬�ɲ�����ˮ�м���������ķ���
C.������B��ʱ����pH=2��������pH=12��KOH�������Ϻ���Һ�Լ���
D.����A�㵽C�㣬�����¶Ȳ���ʱ��ˮ�м�������NH4Cl����ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
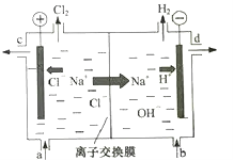
���������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ___��
��2�����Ʊ���ʳ��ˮ��ͼ��___λ�ò��䣬����������Һ��ͼ��___λ��������ѡ����a������b������c������d������
��3��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�
д���÷�Ӧ�Ļ�ѧ����ʽ___��
��4�������£�0.1mol/LNaClO��Һ��pH___0.1mol/LNa2SO3��Һ��pH��ѡ��������������С������������������
��5��Ũ�Ⱦ�Ϊ0.1mol/L��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊ___��
��֪��H2SO3��Ki1=1.54��102��Ki2=1.02��107��HClO��Ki1=2.95��108��H2CO3��Ki1=4.3��107��Ki2=5.6��1011��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��NH4+��ˮ��ƽ�ⳣ��ΪKb=5.556��10 -10�����¶��£���0.100 mol��L-1�İ�ˮ�ζ�10.00ml 0.050 mol��L-1�Ķ�Ԫ��H2A����Һ���ζ������м��백ˮ�����(V ����Һ��lg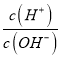 �Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
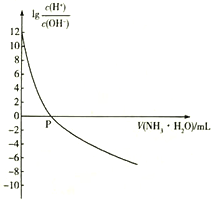
A. H2A�ĵ��뷽��ʽΪH2A![]() H++A2-
H++A2-
B. 25��ʱ��Kb(NH3��H2O)=1.8��10-5
C. P��ʱ���백ˮ�����Ϊ10 mL
D. ��H2A��Һ�еμӰ�ˮ�Ĺ����У�ˮ�ĵ���̶���С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com