
【题目】某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。据图判断正确的是( )
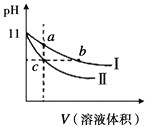
A.Ⅰ为氨水稀释时的pH值变化曲线
B.a、b、c三点溶液的导电性:c>b=a
C.a、b、c三点溶液中水的电离程度:c=b>a
D.用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
【答案】AC
【解析】
某温度下,相同pH的氨水和氢氧化钠溶液,氨水中存在未电离的分子,加水稀释时,平衡向电离的方向移动,而NaOH完全电离,加水稀释时,氢氧根离子浓度减小的程度比氨水大,故I为氨水稀释的图像,II为NaOH稀释时的图像。
A.分析可知,Ⅰ为氨水稀释时的pH值变化曲线,A说法正确;
B.a、b、c三点pH越大,离子浓度越大,导电能力越强,则溶液的导电性:a>c,B说法错误;
C.a、b、c三点均为碱溶液,pH越大,对水的电离抑制程度越大,溶液中水的电离程度:b=c>a,C说法正确;
D.pH相同,氨水中存在未电离的分子,则氨的物质的量大于NaOH,用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,氨水消耗盐酸的体积大,即Vb>Vc,D说法错误;
答案为AC。


科目:高中化学 来源: 题型:
【题目】在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2![]() 2NH3。在一定温度下达到平衡,H2的转化率为20%。若在同一容器中充入NH3, 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是
2NH3。在一定温度下达到平衡,H2的转化率为20%。若在同一容器中充入NH3, 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是
A.15mol 20% B.20mol 20% C.20mol 80% D.40mol 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。
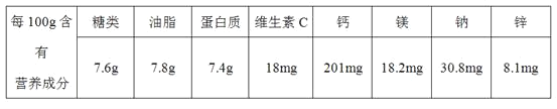
该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡,此时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的化学反应速率___;
(2)10min内SO2的转化率___;
(3)平衡常数K___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6 mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,样品总失重13.8 mg。高岭石受热分解反应方程式:Al4Si4O10(OH)8 →2Al2O3+4SiO2+4H2O
(1)硅原子核外电子排布在____个不同的电子层中,核外最外层电子分布在____个不同的轨道中。
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式________。
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为_________________。
(4)此矿物中高岭石的质量分数为____________。
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):_____________________。
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2 ![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si+4HCl
Si+4HCl
第二种方法:Si+3HCl ![]() SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2![]() Si+3HCl。
Si+3HCl。
工业上常用第二种方法来提纯单晶硅,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在H2O![]() H++OH--Q的平衡,下列叙述一定正确的是( )
H++OH--Q的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出)。完成下列填空:

(1)乙醇能与乙酸反应生成有果香味的物质,其名称为_______,该反应类型是_________。
(2)反应⑥的化学方程式是 _________________,实验现象是 _____________。
(3)反应③用KOH的乙醇溶液处理二氯乙烯的方程式为 ________。
(4)苯乙烯中所含官能团的名称 ____________________。
(5)苯乙烯合成聚苯乙烯的化学方程式是 _______________________。
(6)以乙醇和苯乙烯为原料合成有机物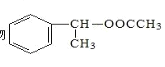 ,写出合成路线图。______
,写出合成路线图。______
合成路线流程图实例如下: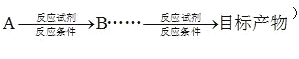
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com