
【题目】地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6 mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,样品总失重13.8 mg。高岭石受热分解反应方程式:Al4Si4O10(OH)8 →2Al2O3+4SiO2+4H2O
(1)硅原子核外电子排布在____个不同的电子层中,核外最外层电子分布在____个不同的轨道中。
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式________。
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为_________________。
(4)此矿物中高岭石的质量分数为____________。
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):_____________________。
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2 ![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si+4HCl
Si+4HCl
第二种方法:Si+3HCl ![]() SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2![]() Si+3HCl。
Si+3HCl。
工业上常用第二种方法来提纯单晶硅,其原因是_________________。
【答案】3 3 Si+2NaOH+H2O→Na2SiO3+2H2↑ NaAlSi3O8 c 2AlCl3+3H2O→Al2O3+6HCl↑ 温度较低,耗能少;HCl可以循环利用
【解析】
(1)根据硅原子核外电子排布分析;
(2)Si与NaOH溶液反应生成硅酸钠和氢气;
(3)根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钠长石的化学式;
(4)由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,方解石分解生成CaO和二氧化碳,高岭石受热分解反应方程式:Al4Si4O10(OH)8→2Al2O3+4SiO2+4H2O,所以减少的质量为二氧化碳和水的质量,列方程组计算;
(5)AlCl3水解生成氢氧化铝,氢氧化铝分解生成氧化铝;
(6)根据反应中能量的消耗和原料的使用来分析。
(1)硅为14号元素,其核外有14个电子,硅原子核外电子排布式为1s22s22p63s23p2,则硅原子核外电子排布在3个电子层,核外最外层电子分布在3个不同的轨道中;
(2)硅与铝同周期且相邻,化学性质有相似性,Si与NaOH溶液反应生成硅酸钠和氢气,则其反应的化学方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑;
(3)结合钙长石的化学式可知钠长石就是将钙长石的中钙更换为钠,铝硅酸阴离子不变,以及化合物中化合价代数和等于0可得钠长石的化学式为NaAlSi3O8;
(4)由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,方解石分解生成CaO和二氧化碳,高岭石受热分解反应方程式:Al4Si4O10(OH)8→2Al2O3+4SiO2+4H2O,所以减少的质量为二氧化碳和水的质量,设矿物中高岭石为x mol,方解石为y mol,则516x+100y=66.6×10-3 g,4x×18+44y=13.8×10-3 g
解得:x=1×10-4 mol,y=1.5×10-4 mol,则高岭石的质量为1×10-4 mol×516 g/mol=51.6×10-3 g=51.6 mg,则此矿物中高岭石的质量分数为![]() ×100%=77.5%,故合理选项是c;
×100%=77.5%,故合理选项是c;
(5)AlCl3是强酸弱碱盐,在溶液中Al3+水解生成氢氧化铝,氢氧化铝分解生成氧化铝,则氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约)为:2AlCl3+3H2O→Al2O3+6HCl↑;
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2 ![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si+4HCl
Si+4HCl
第二种方法:Si+3HCl ![]() SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2![]() Si+3HCl。
Si+3HCl。
第二种方法反应温度较低,能量消耗少,而且HCl能循环使用。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
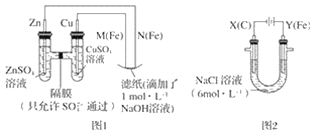
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杯环芳烃因其结构类似于酒杯而得名,其键线式如图,下列关于杯环芳烃的说法正确的是( )
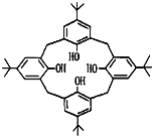
A.属于芳香烃B.最多与6mol H2发生加成反应
C.分子式为C44H56O4D.分子内所有原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。据图判断正确的是( )
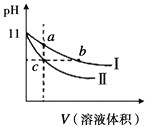
A.Ⅰ为氨水稀释时的pH值变化曲线
B.a、b、c三点溶液的导电性:c>b=a
C.a、b、c三点溶液中水的电离程度:c=b>a
D.用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将17.6克Fe2O3和Cu的混合物溶解于足量的稀盐酸中,再加铁粉9.8克,待铁粉溶解后,溶液中无Fe3+,此过程共产生2.24升H2(标况),则下列判断正确的是
A.混合物中Cu全部被氧化为Cu2+以后,Cu2+又全部被还原
B.混合物中Cu全部被氧化为Cu2+以后,Cu2+又部分被还原
C.混合物中Cu部分被氧化为Cu2+以后,Cu2+又全部被还原
D.混合物中Cu部分被氧化为Cu2+以后,Cu2+又部分被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:
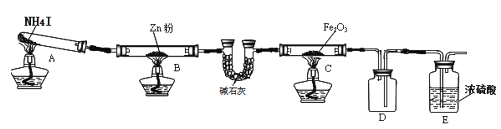
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
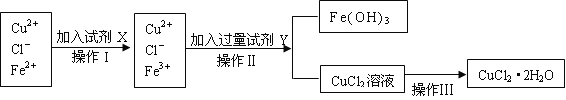
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
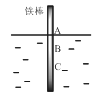
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
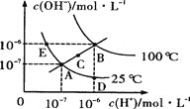
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显碱性
D.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com