
【题目】在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡,此时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的化学反应速率___;
(2)10min内SO2的转化率___;
(3)平衡常数K___。
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。据图判断正确的是( )
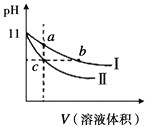
A.Ⅰ为氨水稀释时的pH值变化曲线
B.a、b、c三点溶液的导电性:c>b=a
C.a、b、c三点溶液中水的电离程度:c=b>a
D.用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B(g)![]() 2C(g)在固定容积的容器中进行,如果向容器中充入1 mol A和1 mol B,在某温度下达平衡时,C的物质的量分数为m%;若向容器中充入1 mol C,在同样条件下,达到平衡时,C的物质的量分数为n%,则m和n的正确关系是( )
2C(g)在固定容积的容器中进行,如果向容器中充入1 mol A和1 mol B,在某温度下达平衡时,C的物质的量分数为m%;若向容器中充入1 mol C,在同样条件下,达到平衡时,C的物质的量分数为n%,则m和n的正确关系是( )
A.m>nB.m<nC.m=nD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:
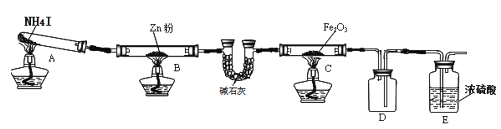
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).

A.△H1 >△H2 △H2<△H3
B.反应HCO3-(aq)+H+(aq)=CO2 (g)+H2O(l)为放热反应
C.H2CO3(aq)= CO2(g)+H2O(l),若使用催化剂,则△H3变小
D.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是( )
A. NaHCO3水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4= Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com