
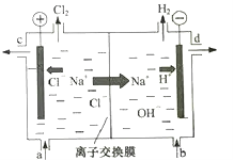
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式___。
(2)精制饱和食盐水从图中___位置补充,氢氧化钠溶液从图中___位置流出(选填“a”、“b”、“c”或“d”)。
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式___。
(4)室温下,0.1mol/LNaClO溶液的pH___0.1mol/LNa2SO3溶液的pH(选填“大于”、“小于”或“等于”)。
(5)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___。
已知:H2SO3:Ki1=1.54×102,Ki2=1.02×107,HClO:Ki1=2.95×108,H2CO3:Ki1=4.3×107,Ki2=5.6×1011。
【答案】2Cl-+2H2O![]() Cl2↑+H2↑+2OH- a d 2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O 大于 c(SO32–)>c(CO32–)>c(HCO3–)>c(HSO3–)
Cl2↑+H2↑+2OH- a d 2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O 大于 c(SO32–)>c(CO32–)>c(HCO3–)>c(HSO3–)
【解析】
电解食盐水时,阳极氯离子失电子生成氯气,阴极氢离子得电子生成氢气。图中的离子交换膜只允许阳离子通过,即只允许钠离子、氢离子通过向阴极移动。
(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应,产生Cl2。反应的离子方程式是2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。阳极氯离子不断消耗,钠离子向阴极移动,导致阳极区钠离子、氯离子减少,故精制饱和食盐水从与阳极连接的图中a位置补充。由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出。
(3)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O。
(4)NaClO、Na2SO3都是强碱弱酸盐,形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7;HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH: NaClO> Na2SO3。
(5)由于电离程度:H2SO3> H2CO3>HSO3->HCO3-,浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3-> HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为c(SO32–)>c(CO32–)>c(HCO3–)
>c(HSO3–)。


科目:高中化学 来源: 题型:
【题目】一定温度下,水存在H2O![]() H++OH--Q的平衡,下列叙述一定正确的是( )
H++OH--Q的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出)。完成下列填空:

(1)乙醇能与乙酸反应生成有果香味的物质,其名称为_______,该反应类型是_________。
(2)反应⑥的化学方程式是 _________________,实验现象是 _____________。
(3)反应③用KOH的乙醇溶液处理二氯乙烯的方程式为 ________。
(4)苯乙烯中所含官能团的名称 ____________________。
(5)苯乙烯合成聚苯乙烯的化学方程式是 _______________________。
(6)以乙醇和苯乙烯为原料合成有机物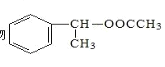 ,写出合成路线图。______
,写出合成路线图。______
合成路线流程图实例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水是氨气的水溶液,主要用作化肥。现有25℃时0.1 mol/L的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中的c(NH4+)_________,溶液的pH_________(填“增大”“减小”“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:____________;所得溶液的pH_________7(填“>”、“<”或“=”),用离子方程式表示其原因________。
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺是_______
(4)实验室可用向浓氨水中加入CaO的方法制取氨气,从氨水中存在的平衡入手分析产生NH3的原因:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个电化学原理的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。填写下列空白:
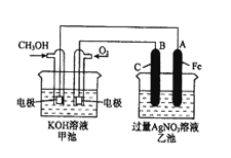
(1)请写出甲、乙两池的名称。甲电池是______,乙池是______。
(2)甲池中通入CH3OH的电极名称是___,电极反应方程式为:______;乙池中B(石墨)电极的名称是_______。
(3)电解过程中,乙池溶液pH的变化为_______(“升高”、“降低”或“不变”)。
(4)当乙池中A(Fe)极的质量增加5.40 g时,甲池中理论上消耗O2_____mL(标准状况下)。
(5)若乙池中的AgNO3换成一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为___mol。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A.平衡逆向移动I-浓度减小B.溶度积常数Ksp减小
C.沉淀溶解平衡不移动D.PbI2的溶解度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com