
【题目】氨水是氨气的水溶液,主要用作化肥。现有25℃时0.1 mol/L的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中的c(NH4+)_________,溶液的pH_________(填“增大”“减小”“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:____________;所得溶液的pH_________7(填“>”、“<”或“=”),用离子方程式表示其原因________。
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺是_______
(4)实验室可用向浓氨水中加入CaO的方法制取氨气,从氨水中存在的平衡入手分析产生NH3的原因:__________
【答案】增大 减小 NH3·H2O+H+=NH4++H2O < NH4++H2O![]() NH3·H2O+H+ c(H+)>c(SO42-)>c(NH4+)>c(OH-) NH3(g)+H2O(l)
NH3·H2O+H+ c(H+)>c(SO42-)>c(NH4+)>c(OH-) NH3(g)+H2O(l)![]() NH3·H2O(aq)
NH3·H2O(aq)![]() NH4+(aq)+ OH-(aq),加入CaO后温度升高,OH-浓度增大,平衡逆向移动,NH3逸出
NH4+(aq)+ OH-(aq),加入CaO后温度升高,OH-浓度增大,平衡逆向移动,NH3逸出
【解析】
(1)硫酸铵电离出NH4+而导致溶液中c(NH4+)增大,结合一水合氨电离平衡分析溶液中c(OH-),再根据水的离子积常数及pH与溶液中c(H+)关系分析判断;
(2)根据酸、碱发生中和反应的物质的量关系,结合电解质强弱书写离子方程式,产生的盐(NH4)2SO4是强酸弱碱盐,利用盐的水解规律,结合溶液中c(OH-)、c(H+)关系分析;
(3)pH=1的硫酸中c(H+)=0.1 mol/L,二者等体积混合,恰好完全反应生成硫酸氢铵,结合盐的电离、铵根离子水解可知导致溶液呈酸性,分析比较溶液中离子浓度关系;
(4)根据CaO与水反应,消耗溶剂,反应放出热量,从温度、物质的浓度改变分析平衡移动。
(1)氨水是氨气的水溶液,存在电离平衡:NH3·H2O![]() NH4++H+,向氨水中加入(NH4)2SO4,盐电离产生NH4+,使溶液中c(NH4+)增大,对电离平衡起抑制作用,导致NH3·H2O电离程度减小,最终达到平衡时溶液中c(OH-)减小,由于温度不变,Kw不变,所以溶液中c(H+)增大,由于pH=-lgc(H+),所以溶液pH减小;
NH4++H+,向氨水中加入(NH4)2SO4,盐电离产生NH4+,使溶液中c(NH4+)增大,对电离平衡起抑制作用,导致NH3·H2O电离程度减小,最终达到平衡时溶液中c(OH-)减小,由于温度不变,Kw不变,所以溶液中c(H+)增大,由于pH=-lgc(H+),所以溶液pH减小;
(2)向氨水中加入硫酸,二者发生中和反应产生(NH4)2SO4和水,反应的离子方程式为:NH3·H2O+H+=NH4++H2O;由于(NH4)2SO4是强酸弱碱盐,在溶液中NH4+发生水解反应:NH4++H2O![]() NH3·H2O+H+,破坏了水的电离平衡,最终达到平衡时溶液中c(H+)>c(OH-)溶液显酸性,所以溶液的pH<7;
NH3·H2O+H+,破坏了水的电离平衡,最终达到平衡时溶液中c(H+)>c(OH-)溶液显酸性,所以溶液的pH<7;
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则二者恰好发生反应产生NH4HSO4,盐在溶液中发生电离作用:NH4HSO4=NH4++H++SO42-,在溶液中NH4+发生水解反应:NH4++H2O![]() NH3·H2O+H+,使c(NH4+)减小,小于c(SO42-);c(H+)增大,大于c(SO42-);根据水的离子积常数不变,可知c(OH-)减小,而c(SO42-)不变,盐电离作用远大于水电离作用,所以c(NH4+)>c(OH-);故溶液中各种离子浓度关系为:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
NH3·H2O+H+,使c(NH4+)减小,小于c(SO42-);c(H+)增大,大于c(SO42-);根据水的离子积常数不变,可知c(OH-)减小,而c(SO42-)不变,盐电离作用远大于水电离作用,所以c(NH4+)>c(OH-);故溶液中各种离子浓度关系为:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(4)氨水中存在平衡:NH3(g)+H2O(l)![]() NH3·H2O
NH3·H2O![]() NH4++H+,向其中加入CaO,会发生反应:CaO+H2O=Ca(OH)2,消耗溶剂水,使平衡逆向移动,CaO与水的反应是放热反应,会使溶液温度升高,加快NH3·H2O分解放出NH3;且Ca(OH)2是强碱,电离产生OH-,使溶液中c(OH-)增大,也会使平衡逆向移动,导致NH3逸出。
NH4++H+,向其中加入CaO,会发生反应:CaO+H2O=Ca(OH)2,消耗溶剂水,使平衡逆向移动,CaO与水的反应是放热反应,会使溶液温度升高,加快NH3·H2O分解放出NH3;且Ca(OH)2是强碱,电离产生OH-,使溶液中c(OH-)增大,也会使平衡逆向移动,导致NH3逸出。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
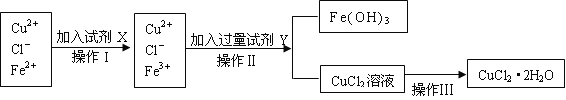
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G是几种烃分子的球棍模型,据此回答下列问题:
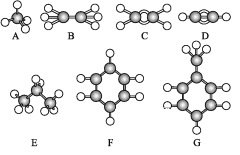
(1)上述七种烃中:
①常温下含碳量最高的气态烃是____(填结构简式)。
②能够发生加成反应的烃有____种。
③与A互为同系物的是____(填对应字母)。
④一卤代物种类最多的是____(填对应字母)。
(2)写出C发生加聚反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
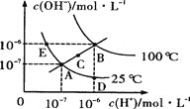
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显碱性
D.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
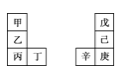
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.常温下甲的单质在水中反应要比乙剧烈很多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
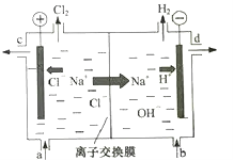
完成下列填空:
(1)写出电解饱和食盐水的离子方程式___。
(2)精制饱和食盐水从图中___位置补充,氢氧化钠溶液从图中___位置流出(选填“a”、“b”、“c”或“d”)。
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式___。
(4)室温下,0.1mol/LNaClO溶液的pH___0.1mol/LNa2SO3溶液的pH(选填“大于”、“小于”或“等于”)。
(5)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___。
已知:H2SO3:Ki1=1.54×102,Ki2=1.02×107,HClO:Ki1=2.95×108,H2CO3:Ki1=4.3×107,Ki2=5.6×1011。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
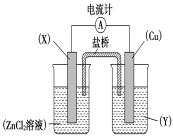
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是__________________。
(2)铜电极为电池的________极,发生的电极反应为_______________________ X极上发生的电极反应为______________。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g金属,则乙池中溶质可能是( )
A.KNO3B.MgSO4C.CuSO4D.Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com