
【题目】在医院中,为酸中毒病人输液不应采用( )
A.0.9%氯化钠溶液
B.0.9%氯化铵溶液
C.1.25%碳酸氢钠溶液
D.5%葡萄糖溶液
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A.![]() mol?L﹣1
mol?L﹣1
B.![]() mol?L﹣1
mol?L﹣1
C.![]() mol?L﹣1
mol?L﹣1
D.![]() mol?L﹣1
mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究。
【实验原理】有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量。
【实验用品】2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5%KSCN溶液、pH=4的HAc-NaAC缓冲溶液、1∶1HNO3溶液、复方硫酸亚铁药片。
铁架台(铁夹)、100 ml容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸。
【实验过程】
Ⅰ.配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL5%KSCN溶液和2.5 mLpH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度。
Ⅱ.制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL1∶1 HNO3溶液,小心加热2~3 min。冷却后,全部移入100 mL容量瓶中,再加入4.0 mL5%KSCN溶液和10.0 mLpH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL。取25.00 mL待测液加入与Ⅰ中相同规格的比色管中。
Ⅲ.比色:将Ⅱ所得比色管中的溶液与Ⅰ中各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围。
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显色。
(2)完成该实验,还缺少的仪器有、。
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是?
(4)实验中量取HNO3溶液、HAc-NaAc缓冲溶液用量筒即可,原因是?
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是?
(6)若测得待测液中Fe3+的物质的量浓度为c mol/L,药片的质量为m , 则药片中铁元素的质量分数为?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法中正确的是( )
A.乙烷中混有乙烯,加入氢气在一定条件下充分反应
B.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液
C.除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液
D.溴苯中混有溴,加入KI溶液后,用分液漏斗分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及结论合理的是( )
A.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
B.用盐酸标准溶液滴定待测的氢氧化钠溶液时,酸式滴定管尖嘴处开始有气泡,滴后气泡消失,会使测定结果偏低
C.用湿润pH试纸测溶液pH时,应用滴管取液滴在试纸上,再与标准比色卡对比
D.取a克Na2CO3和NaHCO3混合物于锥形瓶中加适量水溶解,酚酞作指示剂,用c mol?L-1的标准盐酸滴定,可测定混合物中Na2CO3的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素的原子序数均小于18,其最高正价依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应水化物是已知无机含氧酸中最强的酸。则:
(1)A、B、C、D分别是________、________、________、________。
(2)A的离子结构示意图为________________,C的原子结构示意图为________________。
(3)C的最高价氧化物对应水化物与A的氢氧化物反应生成________种盐,其化学式为________、________、________ (可不填满,也可补充)。
(4)C、D的气态氢化物稳定性由强到弱的顺序是________________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
A.等体积、等物质的量浓度的明矾溶液和Ba(OH)2溶液混合:3Ba2++6OH﹣+2Al3++3SO ![]() ═2Al(OH)3↓+3BaSO4↓
═2Al(OH)3↓+3BaSO4↓
B.FeCl2在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH﹣
C.AlCl3(aq)中投入过量Na:2Al3++6Na+6H2O═2Al(OH)3↓+6Na++3H2↑
D.4molFeBr2(aq) 中通入3molCl2:2Fe2++4Br﹣+3Cl2═2Fe3++2 Br2+6Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写:
(1)在NaCl、NaOH,Na2O2、N2、H2S,H2O2中,既含有离子键又含有极性键的是___, 既含有离子键又含有非极性键的是___;
(2)32号元素在元素周期表中的位置___;
(3)KClO3可用于实验室制O2 , 若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为相关物质之间的转化关系,其中甲、乙为生活中常见的金属单质,丙、丁在常温下为气态非金属单质,A~F为化合物(水均已略去)。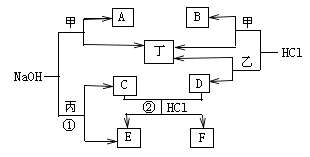
请回答:
(1)组成丙的元一素在元素周期表中的位置为;利用反应① ,工业上常制备(填产品名称)。
(2)C的电子式为;反应②的离子方程式为。
(3)将A、B的水溶液混合,反应的离子方程式为。
(4)将B 的稀溶液加水稀释,在下图中画出溶液pH 随加水体积的变化曲线.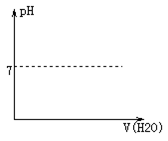
(5)工业上冶炼金属甲的化学方程式为。
(6)将等物质的量的A和NaOH混合溶于水,该溶液中各离子的物质的量浓度由大到小的顺序为。
(7)检验F中阳离子的方法为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com