
【题目】按要求书写:
(1)在NaCl、NaOH,Na2O2、N2、H2S,H2O2中,既含有离子键又含有极性键的是___, 既含有离子键又含有非极性键的是___;
(2)32号元素在元素周期表中的位置___;
(3)KClO3可用于实验室制O2 , 若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___ .
【答案】 NaOH Na2O2 第四周期第ⅣA族 4KClO3 ![]() KCl+3KClO4
KCl+3KClO4
【解析】(1)NaCl中钠离子和氯离子之间只存在离子键;NaOH中钠离子和氢氧根离子之间为离子键,氧原子和氢原子之间为极性共价键;Na2O2中钠离子和过氧根离子之间为离子键,氧原子和氧原子之间为非极性共价键;N2中氮原子之间为非极性共价键;H2S中氢原子和硫原子之间为极性共价键;H2O2中氢原子和氧原子之间为极性共价键,氧原子和氧原子之间为非极性共价键;既含有离子键又含有极性键的是NaOH,有离子键又含有非极性键的是Na2O2;正确答案:NaOH 、Na2O2。
(2)根据稀有气体36号元素氪的核外电子排布:2、8、18、8规律由此往前推,32号元素核外电子排布:2、8、18、4,由此可知32号元素在第四周期第IVA族;所以;正确答案:第四周期第ⅣA族。
(3)无氧酸盐为KCl,氯元素的化合价为-1价,说明KClO3中氯元素由+5价降低到-1价,另外一种含氧酸盐中氯元素化合价定会从+5价升高到+7价,变为高氯酸钾,反应的方程式4KClO3 ![]() KCl+3KClO4;正确答案:4KClO3
KCl+3KClO4;正确答案:4KClO3 ![]() KCl+3KClO4。
KCl+3KClO4。


科目:高中化学 来源: 题型:
【题目】人的血液里Ca2+的浓度一般采用g·cm-3表示,今抽一血样20.00 mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀冼净后溶于强酸可得草酸,再用浓度为0.02 mol·L-1的KMnO4溶液滴定。当观察到溶液紫色褪尽时,共消耗12.00 mL KMnO4溶液。则该血液样品中Ca2+的浓度为( )
A.0.0015 g·cm-3
B.0.0012 g·cm-3
C.0.0024 g·cm-3
D.0.002 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。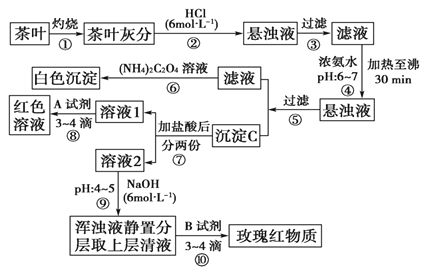
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是。
(2)写出检验Ca2+的离子方程式:。
(3)写出沉淀C所含主要物质的化学式:。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式?
(5)步骤⑨的作用是 ,
猜测步骤⑩的目的是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在.标况下测定)( )
A. 若提供0.4 mol HCl,MnO2过量,则可制得氯气4.48 L
B. 若提供0.4 mol HCl,MnO2过量,则转移电子数一定为0.1mol
C. 若有0.4 mol HCl参加反应,则可制得氯气2.24 L
D. 若有0.4 mol HCl被氧化,则可制得氯气2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了测定三聚氰胺的分子式和结构简式设计了如下实验。他查阅资料得知:三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。现有12.6 g三聚氰胺晶体按下图所示实验装置反应(假设三聚氰胺完全转化成产物)。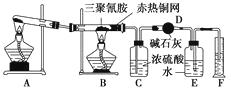
(1)写出A装置中发生反应的化学方程式:。
(2)C装置能不能与D装置互换?(填“能”或“不能”),理由是。
(3)当B装置中反应完全后,读取F中水的体积,实验操作顺序为(填序号)。
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如下:
仪器 | C | D |
实验前 | 101.0 g | 56.0 g |
实验后 | 106.4 g | 69.2 g |
经测定,收集到的气体折合成标准状况下的体积为6.72 L。
①利用上述实验数据,通过计算可知三聚氰胺的实验式为。
②三聚氰胺的分子式为。
③若装置中没有铜网,则对测定结果的影响是。
(5)已知氰酸(HCN)的结构简式为H—C≡N,氰胺的结构简式为H2N—C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据框图反应关系,写出下列B、C、D、E所含物质的化学式

沉淀固体B_________;C_________;沉淀D ___________。
(3)写出②的离子反应方程,③的化学反应方程。
②_________________________________;
③_________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)为了达到下表中的实验要求,请选择合适的试剂及方法,将其标号填入对应的空格中。
实验要求 | 试剂及方法 | ||
鉴别Na2SO4溶液和NaCl溶液 | A.分别加入氯化钡溶液,观察现象 | ||
证明盐酸溶液呈酸性 | B.将气体分别通过盛有品红溶液的洗气瓶 | ||
鉴别二氧化硫和二氧化碳 | C.加入几滴碘水,观察现象 | ||
检验淘米水中是否含有淀粉 | D.在溶液滴加紫色石蕊,溶液变红 | ||
(二).甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物 .
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NOFe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
|
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 .
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 .
(3)证明A溶液中是否含有Fe3+ , 选择的药品是(填序号)( )
A.铁粉
B.溴水
C.铁氰化钾溶液
D.硫氰化钾溶液.
(4)根据实验现象写出A中一定发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。‘
(1)浓硫酸的作用是;
简述混合液体时最后加入浓硫酸的理由:。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用装置(填“甲”或“乙”或“丙”)。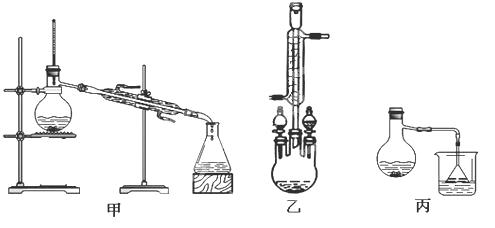
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ。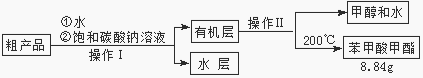
(4)能否用NaOH溶液代替饱和碳酸钠溶液?(填“能”或“否”),
并简述原因。
(5)通过计算,苯甲酸甲酯的产率是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com