
【题目】高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4 +3KCl + 5H2O,下列说法正确的是
A.制高铁酸钾用KClO做还原剂
B.高铁酸钾中铁的化合价为+7
C.KCl是还原产物
D.制备高铁酸钾时1molFe(OH)3得到3 mol电子
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名:
①有机物CH3CH(C2H5)CH(CH3)2的名称是 .
②在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”.C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称 .
(2)写出下列各种有机物的结构简式.
①2,3﹣二甲基﹣4﹣乙基已烷
②支链只有一个乙基且式量最小的烷烃 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料是不可再生的,最终将会枯竭.基于我国目前的技术水平和管理水平,能源从开采、运输、加工到终端的利用效率都很低,浪费很大.据统计,开采效率为32%,加工运输效率为70%,终端利用率为41%,则总效率近似为( )
A.1.43%
B.14.3%
C.9.18%
D.91.8%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体氯化钠配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的( )
A. 500 mL容量瓶 B. 胶头滴管 C. 试管 D. 托盘天平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物结构和性质的说法正确的是
A. 乙烯、苯和乙酸均能与氢气发生加成反应
B. 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种
C. 1 mol的有机物(结构如右图)最多能与含5mol NaOH的水溶液完全反应

D. 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是( )
A.热稳定性:H2O>NH3>PH3
B.原子半径:Si>Na>O
C.碱性:CsOH>KOH>NaOH
D.失电子能力:K>Na>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿的主要成分是Cu2S,可用于制取金属铜和铜盐。
(1)己知部分反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) ΔH1=akJ·mol-1
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) ΔH2=bkJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH3=ckJ·mol-1
则C(s)+2Cu2S(s)=4Cu(s)+CS2(g)的ΔH=_________kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为_______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是______________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图。其原因是_____________。


③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:__________,CuCl+FeCl3=CuCl2+FeCl2。
(3)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图。转化时正极的电极反应式为_________________。
(4)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq) ![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
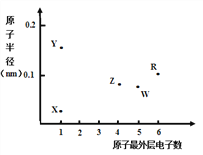
A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com