
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:
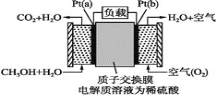
(1)该装置的能量转化形式为________。
(2)Pt(a)电极是电池________(填“正”或“负”)极;
(3)电解液中的H+向_____(填“a”或“b”)极移动;
(4)如果该电池工作时消耗1 mol CH3OH,则电路中通过___ mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是________。
【答案】化学能转化为电能 负 b 6 对环境无污染
【解析】
该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,电极反应为:CH3OH+H2O-6e-═CO2+6H+,通入氧气的电极为正极,氧气得到电子生成氢氧根离子,电极反应O2+4H++4e-═2H2O,据此解答。
(1)该装置的能量转化形式为原电池反应是化学能转化为电能;
(2)Pt(a)电极甲醇通入失电子发生氧化反应,是电池负极;
(3)燃料电池中,通入燃料的电极Pt(a)为负极,负极上失电子发生氧化反应,通入氧气的电极Pt(b)为正极,氧气得到电子生成氢氧根离子,电解液中的H+向正极移动,即向b电极移动;
(4)通入燃料的电极为负极,负极上失电子发生氧化反应,电极反应为:CH3OH+H2O-6e-═CO2+6H+,电子守恒,该电池工作时消耗1 mol CH3OH,则电路中通过6mol电子;
(5)燃料电池的能量转化率高,甲醇反应产物为CO2和H2O,对环境无污染。


科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质质量不变的是
A. 在试管中加热小苏打粉末 B. 铝丝插入Cu(NO3)2溶液中
C. 在O2中灼烧Cu2S使之转化为CuO D. 水蒸气通过高温炽热的铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,有关反应焓变的判断正确的是( )
C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
A. ΔH1>0,ΔH3<0 B. ΔH2>0,ΔH4>0
C. ΔH1=ΔH2+ΔH3 D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。空气吹出SO2吸收法工艺流程如下:

(1)步骤③的离子方程式: _________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的反应原理,不正确的是
A. 铝热法炼铁:Fe2O3 + 2Al 高温Al2O3 + 2Fe
B. 火法炼铜:Cu2S + O2 高温2Cu + SO2
C. 电解法制钠:2NaCl(熔融) 电解2Na + Cl2↑
D. 电解法制镁:2MgO(熔融) 电解2Mg + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液。 | 试管A、B中均未明显见到有气泡产生。 |
(1)实验①的目的是___________________________________________,实验中滴加FeCl3溶液的目的是________________________________。
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________________________________________________________(用实验中所提供的几种试剂)。
(3)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图甲所示,则A、B、C三点所表示的瞬时反应速率最慢的是_____________。
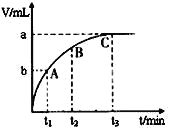
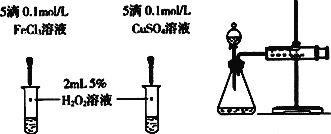
甲 乙 丙
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图乙、丙所示的实验。请回答相关问题:
①定性如图乙可通过观察_________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________________________。
②定量用图丙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______________________________。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2 。然后以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
A. V甲=V乙>V丙 B. V丙>V乙>V甲 C. V乙>V丙>V甲 D. V甲=V乙=V丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com