
【题目】欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
小组 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
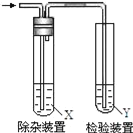
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】某化合物的结构如图所示,分子中所有原子都达到了 8电子稳定结构,X、Y、Z、W是原子序数依次增大的短周期主族元素,原子半径:r(X)>r(Y)>r(Z),W的单质可用来制取漂白剂和自来水消毒。下列说法正确的是
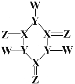
A.YZ2属于酸性氧化物
B.X的氧化物的水化物酸性弱于W的氧化物的水化物酸性
C.X、Y、Z与氢元素均可形成含非极性键的二元化合物
D.Z分别与W、X、Y形成的二元化合物均不止一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
(1)炼钢开始和结束阶段都可能发生反应:Si+2FeO![]() 2Fe+SiO2,其目的是________________.
2Fe+SiO2,其目的是________________.
A.得到副产品硅酸盐水泥 B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质 D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯),在上述由SiCl4制纯硅的反应中,测得每生成 1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________.
Si(纯),在上述由SiCl4制纯硅的反应中,测得每生成 1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________.
对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________________
A.NaX易水解
B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4
D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅.硅烷的热稳定性弱于甲烷,所以Si元素的非金属性弱于C元素,用原子结构解释其原因:________________.
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)Si(s)+3HCl(g)制得高纯硅.不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示.下列说法正确的是________________(填字母序号).

a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3.室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是___________,其原因是________________.已知:H2SiO3:Ka1=2.0×10﹣10、Ka2=1.0×10﹣12,H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10 ﹣11.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
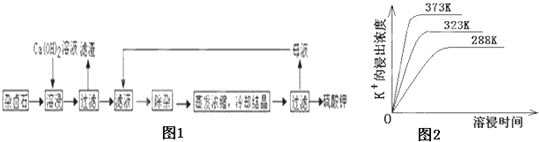
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)第三周期元素的原子所形成的简单离子中:半径最大的阴离子是__;氧化性最强的阳离子是__.
(2)下列事实可以作为S和Cl非金属性强弱的判断依据的是__(选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S.
(3)硅元素最外层有__种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式:__.
(4)PH3和NH3的某些化学性质相似.下列对晶体PH4I性质的推测,错误的是__(选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应.
(5)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似.下列有关说法不正确的是__(选填序号)
a.S2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为﹣1价
d.S2C12分子中各原子均为8电子稳定结构.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和H2在生产、生活、科技中是非常重要,已知:①2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
②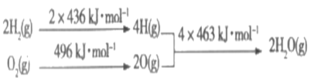
下列推断正确的是
A.C(s)的燃烧热为110.5kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
C.C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1
D.将2mol H2O(l)分解成H2(g)和O2(g),至少需要提供4×463kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能含有K+、Mg2+、Al3+、AlO2—、SiO32—、SO32—、CO32—、SO42—中的若干种离子。某同学对该溶液X进行了如下实验;下列判断正确的是( )
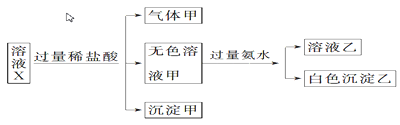
A. 气体甲一定是纯净物
B. K+、AlO2—和SiO32—一定存在于溶液X中
C. 沉淀甲是硅酸和硅酸镁的混合物
D. 凭以上实验能确定SO42—是否存在于溶液X中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com