
【题目】某小组取一定质量的 FeSO4 固体,利用下图装置进行实验。


已知:SO2 熔点-72℃,沸点-10℃;SO3 熔点 16.8℃,沸点 44.8 ℃。
(1) 实验①反应后, A 中的红棕色固体是______,B 中的白色沉淀是_______。
(2)实验③反应的离子方程式是___________。
(3)分解过程除产生使木条复燃的气体外,仅由 A 中固体颜色变化推测,还一定有________气体,依据是_________。
(4)实验④反应的离子方程式是_______。
(5)某同学依据 B 中的现象,认为 FeSO4 分解一定有 SO3 生成。你认为是否正确,并说明原因:__________(用必要的文字和化学方程式解释)。
【答案】![]()
![]()
![]()
![]()
![]() 被氧化成了
被氧化成了![]() ,则
,则![]() 必定被还原,得到
必定被还原,得到![]() 气体
气体 ![]() 正确,
正确,![]() 与
与![]() 不反应,
不反应,![]() 可以和
可以和![]() 反应
反应![]() ,得到
,得到![]() 白色沉淀
白色沉淀
【解析】
首先A处加热硫酸亚铁使其分解,氮气既作为保护气,又可将硫酸亚铁的分解产物“吹”入后续装置,硫酸亚铁分解变为红棕色物质,只能是![]() ,
,![]() 不与
不与![]() 反应,因此推测分解产物中有
反应,因此推测分解产物中有![]() ,
,![]() 可以直接和
可以直接和![]() 反应得到
反应得到![]() 白色沉淀;根据实验②可以证明分解产物中有氧气,根据实验③和实验④证明D中有
白色沉淀;根据实验②可以证明分解产物中有氧气,根据实验③和实验④证明D中有![]() 固体,因此硫酸亚铁的分解产物有
固体,因此硫酸亚铁的分解产物有![]() 、
、![]() 、
、![]() 和
和![]() 。
。
(1)根据分析,红棕色固体是![]() ,而B中的白色沉淀为
,而B中的白色沉淀为![]() ;
;
(2)实验③即![]() 溶于盐酸,其离子方程式为
溶于盐酸,其离子方程式为![]() ;
;
(3)A中的颜色变化即![]() 被氧化成了
被氧化成了![]() ,根据氧化还原反应的“有升必有降”原则,一定还有一种元素的化合价降低,氧已经是-2的最低价无法继续降低,则只能是硫元素化合价降低,得到+4价的
,根据氧化还原反应的“有升必有降”原则,一定还有一种元素的化合价降低,氧已经是-2的最低价无法继续降低,则只能是硫元素化合价降低,得到+4价的![]() 气体;
气体;
(4)实验④即![]() 溶液和
溶液和![]() 固体之间的氧化还原反应,离子方程式为
固体之间的氧化还原反应,离子方程式为![]() ;
;
(5)正确。![]() 与
与![]() 不会发生任何反应,但是
不会发生任何反应,但是![]() 可以和
可以和![]() 发生反应
发生反应![]() ,从而得到白色沉淀。
,从而得到白色沉淀。


科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() 俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。
俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。![]() 易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
![]() 在潮湿空气中氧化,生成的两种常见酸式盐是________
在潮湿空气中氧化,生成的两种常见酸式盐是________![]() 填化学式
填化学式![]() 。
。
![]() 锌粉法制备
锌粉法制备![]() 的工艺流程如下图所示:
的工艺流程如下图所示:
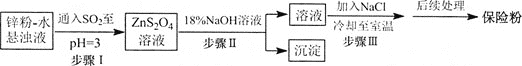
![]() 工业上常将锌块进行预处理得到锌粉
工业上常将锌块进行预处理得到锌粉![]() 水悬浊液,其目的是________。
水悬浊液,其目的是________。
![]() 步骤Ⅰ中发生反应的化学方程式为________。
步骤Ⅰ中发生反应的化学方程式为________。
![]() 在步骤Ⅲ中得到的
在步骤Ⅲ中得到的![]() 固体要用乙醇洗涤,其优点是________,“后续处理”最终要加入少量的
固体要用乙醇洗涤,其优点是________,“后续处理”最终要加入少量的![]() 固体,其原因是________。
固体,其原因是________。
![]() 目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入
目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入![]() 发生反应,有
发生反应,有![]() 气体放出,总反应的离子方程式是________。
气体放出,总反应的离子方程式是________。
![]() 有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠
有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠![]() ,并获得中国专利。电解过程中,阴极室生成
,并获得中国专利。电解过程中,阴极室生成![]() ,a极的电极反应式为________,通过阳离子交换膜的离子主要是
,a极的电极反应式为________,通过阳离子交换膜的离子主要是![]() ,其迁移方向是________。
,其迁移方向是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体 A 的化学式为 NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,则下列有关说法不正确的是( )
A.NH5 中既有共价键又有离子键,NH5 是离子化合物
B.1 mol NH5 中含有 5NA 个 N—H 键(NA 表示阿伏加德罗常数)
C.NH5 的电子式为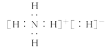
D.A 与水反应的化学方程式为 NH5+H2O=NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
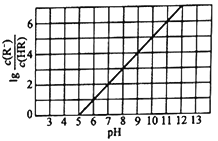
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH)c (HR)] 逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.“一代材料,一代飞机”,据悉2017年国产大飞机C919中使用了素有“现代工业骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料
B.离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜
C.雾霾是一种分散系,带活性炭口罩的原理是吸附作用
D.煤炭经蒸馏,气化,液化等过程,可获得清洁能源和重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“储存”在物质内部的化学能可通过原电池转化为电能,如图所示是某同学设计的几种装置,其中能构成原电池的是( )
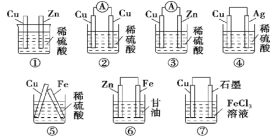
A. ③⑤⑦B. ③④⑤C. ④⑤⑦D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气溶于水形成的饱和溶液中,存在以下的溶解平衡和电离平衡:NH3+H2O![]() NH3H2O,NH3H2O
NH3H2O,NH3H2O![]() NH4++OH-,这些平衡都满足勒夏特列原理,若向已达到平衡的体系中通入下列物质,请填空。
NH4++OH-,这些平衡都满足勒夏特列原理,若向已达到平衡的体系中通入下列物质,请填空。
(1)加入少量氨气,平衡向___(填“正”或“逆”,下同)反应方向移动。
(2)通入HCl气体,平衡向___反应方向移动,c(NH4+)___(填“增大”或“减小”,下同)。
(3)加入NaOH固体,平衡向___反应方向移动,c(OH-)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物结构、性质相关的叙述不正确的是 ( )
A.石油裂解气能使溴的四氯化碳溶液、酸性![]() 溶液褪色
溶液褪色
B.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
C.乙烷中混有少量的乙烯,可通过酸性高锰酸钾溶液进行除杂
D.乙醇、乙酸、乙酸乙酯都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:(已知:Fe3+在PH=3.7时就完全生成氢氧化铁沉淀)

(1)“浸出”时,原料中的铜均转化为硫酸铜。写出相应的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除尽,你的检验方法是________________
(3)调节pH的目的是____________。从滤液到胆矾应采用_________________过滤。
(4)气体a可以被循环利用,用化学方程式表示其被循环利用的原理为:2NO+O2=2NO2、_________________
(5)在农业上,将胆矾、生石灰和水按一定比例混合制成波尔多液,其反应的化学方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com