
下图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
A.元素b位于ⅥA族,有+6、-2两种常见化合价
B.五种元素中,元素e的性质最稳定
C.原子半径有d>c>b
D.元素e参与形成的化合物可以作为一种半导体材料
| a | |||
| b | |||
| c | d | ||
| e |
【知识点】有机化学基础
【答案解析】D 解析:a、b、c、d、e为元素周期表中前四周期的一部分元素,根据元素所在位置,可推知a为He、b为O、d为Cl、c为P、e为As.
A、元素b为氧,位于ⅥA族,但氧元素没有+6价,故A错误;B、同周期自左而右非金属性增强,同主族自上而下非金属性减弱,五种元素中As的非金属性最弱,其氢化物最不稳定,故B错误;
C、同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:c>d>b,故C错误;D、As位于金属与非金属交界处,形成的化合物可以作为一种半导体材料,故D正确;
故答案选D
【思路点拨】本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意掌握微粒半径比较及金属性、非金属性强弱比较。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列溶液中各微粒的浓度关系正确的是
A.pH=4的盐酸中:c(H+)=4.0mol·L-1
B.NH4Cl溶液中:c(Cl-)=c(NH4+)
C.NaCl溶液中:c(Na+) + c(H+)= c(Cl-)+c(OH-)
D.NaHCO3溶液中:c(HCO3-)+c(H2CO3)+ c(CO32-) =c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下图的说法正确的是
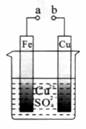
A.构成原电池时Cu是负极
B.构成电解池时Cu是阴极
C.构成电解池时质量增重的极是阴极
D.电池工作时溶液中的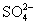 一定移向Cu极
一定移向Cu极
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |
(2)一定温度下,在2L体积不变的密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示:
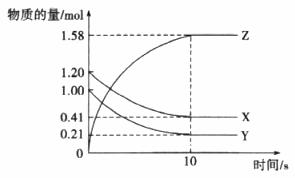
①写出该反应的化学方程式__________。
②从反应开始到10 s,用Z表示的反应速率为__________mol/(L·s)。
③该反应的化学平衡常数为__________(结果保留整数)。
④当反应进行到15 s时,向密闭容器中通入氩气,此时用Z表示的反应速率__________(填“小于”或“等于”或“大于”)10 s时用Z表示的反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
A.先加足量的酸性高锰酸钾溶液,然后再加入溴水
B.先加足量溴水,然后再加入酸性高锰酸钾溶液
C.分别点燃这两种液体,观察现象
D.加入浓硫酸与浓硝酸后加热
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下,将一定质量的Fe、Fe2O3 、Fe3O4 的混合物平均分成两份,一份溶于足量稀硝酸中恰好完全反应,生成0.1 mol NO气体, 将另一份溶于足量稀盐酸中生成一定量气体,向两次反应后溶液中加入硫氰化钾溶液,溶液颜色均无明显变化,则固体溶于盐酸后生成气体的体积为( )
A.2240mL B. 3360mL C. 3675mL D. 4480mL
查看答案和解析>>
科目:高中化学 来源: 题型:
基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为 ( )
A. p区、第五周期、ⅠB族 B. ds区、第五周期、ⅠB族
C. d区、第四周期、ⅠB族 D. ds区、第五周期、Ⅷ族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com