
【题目】W、X、Y、Z均为短周期元素,X、W可形成两种液态化合物甲和乙,其原子个数比分别为1∶1(甲)和2∶1(乙),且分子中电子总数分别为18(甲)和10(乙)。X与Z能形成一种极易溶于水的碱性气体丙X与Y能形成极易溶于水的酸性气体丁,丁分子中的电子数为18。X、Y、Z能形成一种离子化合物,其水溶液呈弱酸性。请写出:
(1)W的元素符号___,其核外共有___种运动状态不同的电子。
(2)甲物质的结构式为___;乙物质的空间构型为___。
(3)Z元素核外共有___种能量不同的电子,碱性气体甲的电子式为___。
(4)用离子方程式解释X、Y、Z形成的化合物水溶液呈弱酸性的原因是___。
(5)铋元素跟Y元素能形成化合物(BiY3),其水解生成难溶于水的BiOY。
①BiY3水解反应的化学方程式为___。
②把适量的BiY3溶于含有少量丁的水中,能得到澄清溶液,试分析可能的原因___。
③医药上把BiOY叫做“次某酸铋”,分析这种叫法的不合理之处,为什么。___。
【答案】O 8 H-O-O-H V型 3 ![]() NH4++H2O
NH4++H2O![]() NH3·H2O+H+ BiCl3+H2O
NH3·H2O+H+ BiCl3+H2O![]() BiOCl↓+2HCl 盐酸能抑制BiCl3的水解 不合理,因为BiOCl中的Cl的化合价为-1
BiOCl↓+2HCl 盐酸能抑制BiCl3的水解 不合理,因为BiOCl中的Cl的化合价为-1
【解析】
W、X、Y、Z均为短周期元素,X、W可形成两种液态化合物甲和乙,其原子个数比分别为1∶1(甲)和2∶1(乙),且分子中电子总数分别为18(甲)和10(乙),则W为O元素,X为H元素,两种化合物甲为H2O2、乙为H2O;X与Z能形成一种极易溶于水的碱性气体丙,则丙为NH3,Z为N元素;H与Y能形成极易溶于水的酸性气体丁,丁分子中的电子数为18,则丁为HCl,Y为Cl元素;H、Cl、N三种元素能组成一种离子化合物,其水溶液呈弱酸性,则此离子化合物为NH4Cl,据此解题。
由分析知:W为O元素、X为H元素、Y为Cl元素、Z为N元素、甲为H2O2、乙为H2O、丙为NH3;
(1)由分析知W为氧元素,元素符号为O,其原子核外共有8个电子,则共有8种运动状态不同的电子;
(2)甲H2O2,为极性分子,含有H-O和O-O键,则结构式为H-O-O-H;乙为H2O,O原子的杂化轨道形式为sp3,有两个孤对电子,则空间构型为V型;
(3)Z为N元素,电子排布式为1s22s22p3,同一轨道上的电子能量相等,则核外共有3种能量不同的电子,碱性气体丙为NH3,其电子式为![]() ;
;
(4)H、Cl、N三种元素组成的离子化合物为NH4Cl,在水溶液中NH4+的水解,使溶液呈弱酸性,发生水解反应的离子方程式为NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(5)铋元素跟Cl元素能形成化合物为BiCl3,其水解生成难溶于水的BiOCl;
①BiCl3水解生成难溶于水的BiOCl,则另一种产物为HCl,水解反应的化学方程式为BiCl3+H2O![]() BiOCl↓+2HCl;
BiOCl↓+2HCl;
②BiCl3溶于稀盐酸,盐酸抑制了BiCl3的水解,从而得到澄清溶液;
③BiOCl中Cl元素的化合价为-1价,而次氯酸中Cl元素为+1价,则BiOCl叫做“次某酸铋”的说法不合理。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸铵是一种传统的氮肥,某种制取硫酸铵的流程如下:
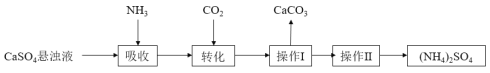
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)在CaSO4悬浊液中通入NH3、CO2生成(NH4)2SO4的化学方程式________________。
(3)为测定硫酸铵的纯度,称取3.000g样品,溶于水,依次加入足量稀盐酸和足量BaCl2溶液,充分反应,过滤,沉淀经洗涤后烘干至恒重,得到4.660 g BaSO4。该硫酸铵的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅均为元素周期表中第IV A族的元素,其单质和化合物有着重要应用。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式________。石墨烯中C的杂化类型为________。
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为________mol。

③石墨烯加氢制得的石墨烷,可用![]() 表示。下列有关叙述正确的是________。
表示。下列有关叙述正确的是________。
a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
④石墨烯可由加热![]() 晶体脱除
晶体脱除![]() 的方法制得。该过程属于________。
的方法制得。该过程属于________。
a.物理变化 b.分解反应 c.氧化还原反应
(2)![]() 的晶体结构与晶体硅类似。
的晶体结构与晶体硅类似。![]() 的晶体类型为________,晶体中
的晶体类型为________,晶体中![]() 原子与
原子与![]() 键的数目之比为________。
键的数目之比为________。
(3)![]() 与
与![]() 空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阻燃剂又称防火剂,主要用于延迟或防止可燃物的燃烧。根据组成,阻燃剂可分为卤系阻燃剂、无机阻燃剂等。
(1)卤系阻燃剂多为有机氯化物和有机溴化物,受热会分解产生卤化氢(HX),起到阻燃作用。卤化氢的电子式为____;HF、HCl、HBr、HI四种氯化氢的沸点由高到低的顺序是___。
(2)溴离子的最外层电子排布式是___;氯原子的核外电子云有___种伸展方向。
(3)下列能说明氯的非金属性强于溴的事实是___(选填编号)。
a.HClO酸性强于HBrO
b.HBr的分解温度低于HCl
c.向溴化亚铁溶液中滴入少量氯水,溶液颜色变黄
d.BrCl+H2O →HBrO+HCl是非氧化还原反应
无机阻燃剂中,氢氧化铝和氢氧化镁两种阻燃剂占据着重要位置。两者的阻燃机理都是在达到热分解温度时迅速分解为氧化物与水,起到吸热降温的作用。
(4)写出氢氧化铝在酸性溶液中的电离方程式___。
(5)两种阻燃剂的分解产物在自然界中最有可能成为原子晶体的是___。(填化学式)
(6)无水碳酸镁也是一种新型无机阻燃剂,除了具有单位质量吸热量更大的特点外,还能释放具有灭火作用的气体。写出该气体的结构式___。
(7)与镁离子核外电子排布相同的另外两个阳离子的半径大小关系为___(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
(1)SO2能使KMnO4溶液褪色,还原产物是MnSO4,写出该反应的化学方程式__________。
(2)将SO2通入BaCl2溶液至饱和,未见沉淀生成,滴加溴水后,出现白色沉淀,该白色沉淀化学式为________。
(3)向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物__________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与__________有关。
(4)已知NaHSO3溶液显酸性,溶液中离子浓度由大到小的顺序是_____________。
(5)为了使Na2S溶液中c(Na+)/c(S2)的比值变小,可适量加入(或通入)的物质是___________
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
(6)在图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)___________H2S。(已知:酸性H2SO4>H2CO3≈H2S)
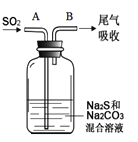
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
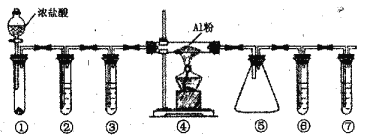
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验:
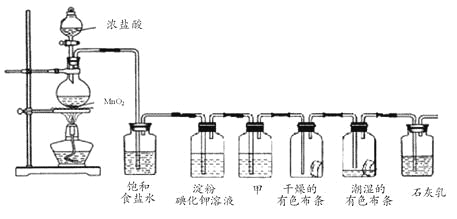
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是________________,反应的离子方程式为_____________。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究碳与浓H2SO4反应的产物,将浓H2SO4和木炭反应产生的气体进行以下实验:
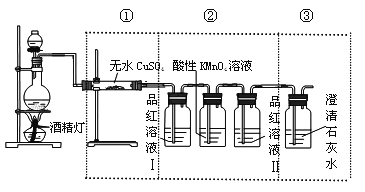
(1)气体通过无水硫酸铜,固体变蓝。说明气体中含有__________;
(2)气体通入品红溶液,溶液褪色;微热,溶液恢复红色。说明气体中含有__________(填“SO2”或“CO2”);
(3)气体通入足量的澄清石灰水,产生白色沉淀。该小组认为气体中含有CO2,你认为该结论:__________(填“正确”或“不正确)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com