
【题目】下列金属冶炼的反应原理及方程式书写,正确的是( )
A.2AlCl3(熔融)![]() 2Al+3Cl2↑B.Fe2O3+2Al
2Al+3Cl2↑B.Fe2O3+2Al![]() Fe+Al2O3
Fe+Al2O3
C.Cu2S+O2![]() 2Cu+SO2D.Ag2O
2Cu+SO2D.Ag2O![]() 2Ag+O2↑
2Ag+O2↑
【答案】C
【解析】
金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.总的说来,金属的性质越稳定,越容易将其从化合物中还原出来.金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来;
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来;
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,据此分析解答。
A.Al为活泼金属,通常用电解熔融的氧化铝的方法冶炼,而氯化铝是分子晶体,其中不含铝离子,所以不能电解氯化铝冶炼金属铝,故A错误;
B.铝热反应:Fe2O3+2Al![]() Fe+Al2O3可将化合物中的铁元素还原为铁单质,但方程式没有配平,故B错误;
Fe+Al2O3可将化合物中的铁元素还原为铁单质,但方程式没有配平,故B错误;
C.火法炼铜的原理为Cu2S+O2![]() 2Cu+SO2,Cu2S在反应中,铜元素化合价从+1价变化降低为0价,硫元素化合价从-2价升高到+4价;所以Cu2S在反应中做氧化剂和还原剂,故C正确;
2Cu+SO2,Cu2S在反应中,铜元素化合价从+1价变化降低为0价,硫元素化合价从-2价升高到+4价;所以Cu2S在反应中做氧化剂和还原剂,故C正确;
D.Ag为不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,选项中反应未配平,正确的反应为2Ag2O![]() 4Ag+O2↑,故D错误;
4Ag+O2↑,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是
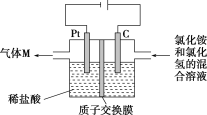
A. 每生成1 mol NCl3,理论上有4 mol H+经质子交换膜右侧向左侧迁移
B. 可用湿润的淀粉KI试纸检验气体M
C. 石墨极的电极反应式为NH4++3Cl--6e-= NCl3 +4H+
D. 电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
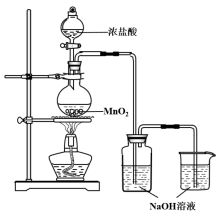
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
a. 测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
b. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(1)写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有 性。
(3) 该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
(4) 有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相对原子质量Cl35.5,Na23,S32,O 16 ,I 127, K39
①达到滴定终点时的实验现象是 。
②此消毒液有效氯含量为 %(保留一位有效数字)。获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=﹣1275.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJmol-1
③H2O(g)=H2O(l) △H3=﹣44.0kJmol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)工业上甲醇利用水煤气合成,反应为CO(g)+2H2(g)=CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点___(填“大”或“小”)。
③生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)CO(g)+3H2(g) △H>0,一定条件下CH4的平衡转化率与温度、压强的关系如图1。则T1___T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为____。

(3)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2。

写出石墨Ⅰ电极上发生反应的电极反应式___。在电解池中生成N2O5的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是

A.正极的电极方程式为:O2 + 2H2O + 4e_=4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.分别向铁、石墨电极附近吹入O2,前者铁锈出现得快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
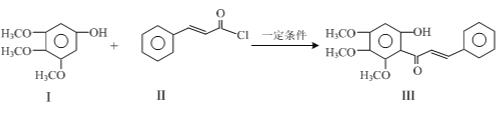 +HCl
+HCl
下列有关叙述正确的是
A.I的分子式为C9H10O4
B.II中所有原子有可能均共面
C.可用FeCl3溶液鉴别有机物I和III
D.1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物![]() 有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
有光学活性。则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A. 与乙酸发生酯化反应
B. 与NaOH水溶液共热
C. 与银氨溶液作用
D. 在催化剂存在下与氢气作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
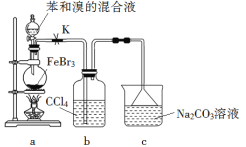
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com