
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
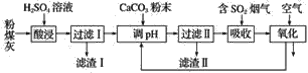
(1)酸浸时反应的化学方程式为_______________________________________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)滤渣Ⅱ的主要成分为________(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为_________________________________________________________________。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为_______________________________________________________。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2O SiO2 CaSO4·2H2O(或CaSO4) 2Al2(SO4)3+3CaCO3+6H2O=Al2(SO4)3·Al2O3+3CaSO4·2H2O+3CO2↑[或2Al2(SO4)3+3CaCO3=Al2(SO4)3·Al2O3+3CaSO4+3CO2↑] 2Al2(SO4)3·Al2(SO3)3+3O2=4Al2(SO4)3[或2Al2(SO3)3+3O2=2Al2(SO4)3]
【解析】
(1)明确氧化铝为两性氧化物,能够与酸反应,二氧化硅为酸性氧化物,不能与硫酸反应;
(2)明确加入碳酸钙的作用以及硫酸铝溶液的性质;
(3)明确硫及其化合物的性质尤其是+4价硫的还原性等。
(1)酸浸时Al2O3与硫酸发生复分解反应,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;SiO2等不能与酸反应,所以滤渣Ⅰ的主要成分是SiO2。
(2)在滤液中含有硫酸铝和过量的硫酸,当向其中加入CaCO3时,会发生复分解反应:CaCO3+H2SO4=CaSO4+CO2↑+H2O;由于硫酸钙微溶于水,所以滤渣Ⅱ的主要成分为CaSO4(或CaSO4·2H2O);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为2Al2(SO4)3+3CaCO3+6H2O=Al2(SO4)3·Al2O3+3CaSO4·2H2O+3CO2↑或2Al2(SO4)3+3CaCO3=Al2(SO4)3·Al2O3+3CaSO4+3CO2↑。
(3)通入空气氧化,空气中的氧气能够把Al2(SO3)3氧化为Al2(SO4)3,发生反应的化学方程式为2Al2(SO4)3·Al2(SO3)3+3O2=4Al2(SO4)3或2Al2(SO3)3+3O2=2Al2(SO4)3。


科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
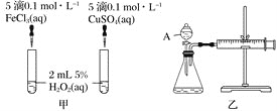
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
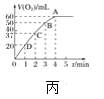
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法正确的是
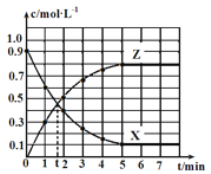
A.2 min内,X的平均反应速率为0.5 mol·L-1·min-1
B.5 min内,反应放出的热量为0.8Q kJ
C.第5 min后,X的生成速率与Y的生成速率相等且保持不变
D.第t min时,该反应未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是

A. 由反应①可知:相同温度下,NaHCO3 的溶解度大于 Na2CO3
B. 反应②的离子方 程式为:Br2+SO2+2H2O=SO42-+2Br-+4H+
C. 可通过电解 MgCl2 溶液制得金属镁
D. 粗盐中含有的 Mg2+、SO4 2-等杂质离子,可通过依次加入 BaCl2溶液、NaOH 溶液、盐酸等试剂加以去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是_____________________________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________。证明炉渣中含有FeO的实验现象为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有160.0g某无色溶液,可能含有盐酸、硫酸镁、硝酸钾、硫酸铜、氯化铝、碳酸钠中的一种或几种。取100.0g该溶液于烧杯中,往其中逐滴加入20.0%的NaOH溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。

(1)推断在该溶液中一定存在的物质是___,一定不存在的物质是___。
(2)原溶液中一种溶质的质量分数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:___________________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com