
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法正确的是
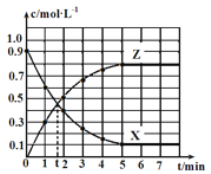
A.2 min内,X的平均反应速率为0.5 mol·L-1·min-1
B.5 min内,反应放出的热量为0.8Q kJ
C.第5 min后,X的生成速率与Y的生成速率相等且保持不变
D.第t min时,该反应未达到平衡状态
【答案】D
【解析】
由图可以知道,X的浓度从开始到5min时一直在减少,第5min时,浓度不再发生变化,则该反应达到平衡状态,
A.结合 计算;
计算;
B.物质的量与反应中热量变化成正比.
C.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
D.平衡时各物质的浓度不变;
A.由图可以知道,2min内,X的浓度变化量为0.9mol/L-0.4mol/L=0.5mol/L,则X的平均反应速率为0.5mol/L÷2min=0.25mol/(L·min),A项错误;
B.5min内参加反应的X为2L×(0.9mol/L-0.1mol/L)=1.6mol,结合热化学方程式可以知道1molX反应放热为QkJ,则反应放出的热量为1.6QkJ,B项错误;
C.第5min后,为平衡状态,Y与X的化学计量数之比为4:1,则Y的生成速率的4倍与X的生成速率相等且保持不变,C项错误;
D.第5min时,X的物质的量浓度不再变化,该反应达到平衡状态,tmin时X的物质的量浓度仍在变化,该反应未达到平衡状态,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
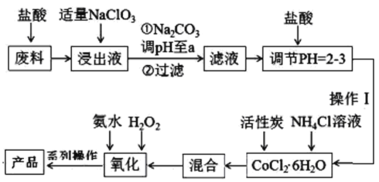
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO42H2O)的常用流程如图:
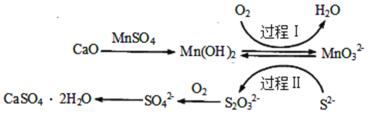
下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2
B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个
C.将10L上清液中的S2-转化为SO![]() (S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
D.过程Ⅱ中,反应的离子方程式为4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-
+4Mn(OH)2↓+10OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下图所示的操作步骤,完成Ba(OH)2·8H2O与氯化铵晶体反应的实验。
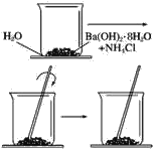
回答下列问题
(1)实验过程中观察到的现象是________________________。
(2)写出该反应的化学方程式___________________。
(3)该反应是放热反应还是吸热反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有 NH3 和(NH4)2CO3,它们与 CO2 可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则 K3=________(用含 K1、K2 的代数式表示)。
(2)利用 CO2 制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:
CO2 催化加氢合成乙烯,其反应为:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始时按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图甲所示:

①a______0(选填“>”或“<”)。
②下列说法正确的是______(填字母序号)。
A 、使用催化剂,可降低反应活化能,加快反应速率
B 、其它条件不变时,若扩大容器容积,则 v正减小,v逆增大
C 、测得容器内混合气体密度不随时间改变时,说明反应已达平衡
③393 K下,H2的平衡转化率为________(保留三位有效数字)。
④393 K下,该反应达到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2 ,则n(H2)/n(C2H4)将____(填“变大”、“不变”或“变小”)。
方法二:
用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
⑤b电极上的电极反应式为_______。
⑥该装置中使用的是__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈Ce(OH)4是一种重要的稀土氢氧化物,它可由氟碳酸铈矿(主要含CeFCO3)经如下流程获得:
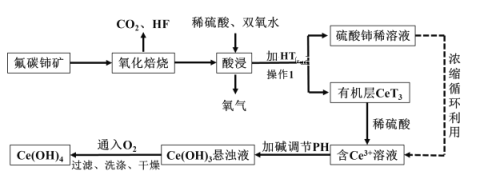
已知:在酸性溶液中![]() 有强氧化性,回答下列问题:
有强氧化性,回答下列问题:
(1)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(2)氧化焙烧生成的铈化合物二氧化铈(CeO2),其在酸浸时反应的离子方程式为___________;
(3)已知有机物HT能将![]() 从水溶液中萃取出来,该过程可表示为:
从水溶液中萃取出来,该过程可表示为:![]() (水层)+
(水层)+![]() (有机层)
(有机层)![]()
![]() +
+![]() (水层)从平衡角度解释:向
(水层)从平衡角度解释:向![]() (有机层)加入
(有机层)加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(4)取某Ce(OH)4产品0.50g,加硫酸溶解后,与23.00mL0.1000mol/L的FeSO4溶液恰好完全反应(铈被还原成Ce3+).(已知:Ce(OH)4的相对分子质量为208)
①FeSO4在该反应中作________剂(填“氧化”或“还原”);
②计算Ce(OH)4产品的纯度____________;
③若用硫酸酸化后改用0.1000mol/L的FeCl2溶液滴定产品从而测定Ce(OH)4产品的纯度,其它操作都正确,则测定的Ce(OH)4产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
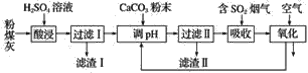
(1)酸浸时反应的化学方程式为_______________________________________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)滤渣Ⅱ的主要成分为________(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为_________________________________________________________________。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pOH=-lg c(OH-),向20 mL 0.1 mol·L-1的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法正确的是
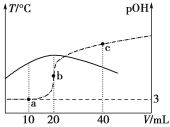
A.稀硫酸的物质的量浓度为0.1 mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+)
D.a、b、c三点对应NH4+的水解平衡常数:Kh(c)>Kh(b)>Kh(a)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com