
【题目】已知pOH=-lg c(OH-),向20 mL 0.1 mol·L-1的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法正确的是
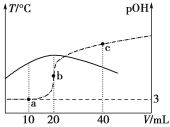
A.稀硫酸的物质的量浓度为0.1 mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+)
D.a、b、c三点对应NH4+的水解平衡常数:Kh(c)>Kh(b)>Kh(a)
【答案】C
【解析】
20 mL0.1molL-1的氨水中滴加未知浓度的稀H2SO4,反应放热,溶液的温度升高,当二者恰好完全反应时,放热最多,溶液的温度最高,所以硫酸的体积为20 mL时,恰好完全反应。
A.20 mL0.1 molL-1的氨水中含有一水合氨的物质的量为n(NH3H2O)=0.1 mol/L×0.02 L=0.002 mol,硫酸的体积为20 mL时,二者恰好完全反应,则消耗硫酸的物质的量为:0.002 mol×![]() =0.001 mol,所以该硫酸的物质的量浓度c(H2SO4)=
=0.001 mol,所以该硫酸的物质的量浓度c(H2SO4)=![]() =0.05 mol/L,A错误;
=0.05 mol/L,A错误;
B.当溶液中pH=pOH时,溶液为中性,此时溶质为硫酸铵和一水合氨,铵根离子的水解程度与氨水的电离程度相等,水的电离几乎没有影响,当氨水与硫酸恰好反应生成硫酸铵时,即b点时,铵根离子水解,促进了水的电离,此时水的电离程度最大,B错误;
C.a点加入10 mL硫酸,有一半的一水合氨被中和形成(NH4)2SO4,反应后溶质为一水合氨和硫酸铵,且一水合氨的浓度为硫酸铵浓度的2倍,根据电荷守恒可得:2c(SO42-)+c(OH-)= c(NH4+)+c(H+),根据物料守恒可得c(NH3·H2O)+c(NH4+)=4c(SO42-),二者结合可得:c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+),C正确;
D.由图可知,温度:b>a>c,温度升高,盐水解程度增大,水解平衡常数也增大,则a、b、c三点NH4+的水解平衡常数:Kh(b)>Kh(a)> Kh(c),D错误;
故合理选项是C。


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法正确的是
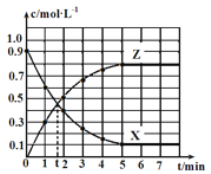
A.2 min内,X的平均反应速率为0.5 mol·L-1·min-1
B.5 min内,反应放出的热量为0.8Q kJ
C.第5 min后,X的生成速率与Y的生成速率相等且保持不变
D.第t min时,该反应未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有160.0g某无色溶液,可能含有盐酸、硫酸镁、硝酸钾、硫酸铜、氯化铝、碳酸钠中的一种或几种。取100.0g该溶液于烧杯中,往其中逐滴加入20.0%的NaOH溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。

(1)推断在该溶液中一定存在的物质是___,一定不存在的物质是___。
(2)原溶液中一种溶质的质量分数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
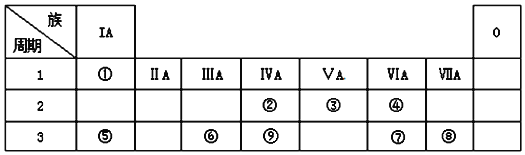
(1)第三周期中元素非金属性最强的元素的原子结构示意图为____________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)___________。
(3)用电子式表示④的简单氢化物的形成过程______________。
(4)下列可以判断⑤和⑥金属性强弱的是_________
a.⑤单质的熔点比⑥单质低
b.⑤的化合价比⑥低
c.⑤单质与水反应比单质⑥剧烈
d.⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
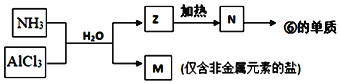
a.M中所含的化学键种类为(若含共价键,请标明极性或非极性)___________。
b.N→⑥的单质的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是氧化铝(Al2O3),在工业上是采用电解氧化铝的方法得出金属铝。
(1)在氧化铝中铝元素与氧元素的质量之比是__________?
(2)用两种方法计算用170 t含氧化铝80%的铝土矿,理论上可冶炼出金属铝__________吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:___________________________。
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com