
【题目】下列实验中,所选用的装置、药品及对应原理都正确的是
选项 | 目的 | 装置 | 原理 |
A | 分离乙酸乙酯和乙醇 |
| 乙酸乙酯和乙醇的密度不同 |
B | 实验室制备氨气 |
|
|
C | 证明非金属性N>C>Si |
| 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
D | 除去丁醇中的乙醚 |
| 丁醇和乙醚的沸点不同 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分。

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是____。
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等。煤焦油经过____(填加工方法)可得到芳香族化合物。
(3)煤的直接液化是煤和适当溶剂混合在高温和____存在下与____作用生成液态燃料的过程。
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为____。
(5)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨--空气混合气体中氧氨比的关系。其中直线表示反应的理论值;曲线表示实际生产情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=___,实际生产将γ维持在1.7~2.2之间,原因是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68L CO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
A.80%B.60%C.40%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
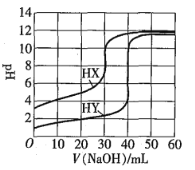
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B.将水加热,KW增大,pH不变
C.向水中加入氨水,平衡逆向移动,c(OH-)降低
D.向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L1nol/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的![]() 与pH变化的关系如图所示.下列叙述正确的是
与pH变化的关系如图所示.下列叙述正确的是
A. M线表示![]() 随pH的变化B. BR溶液呈碱性
随pH的变化B. BR溶液呈碱性
C. 若温度升高,两条线均向上平移D. 常温下,0.1mol·L-1NaR溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
A. 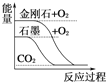 石墨转变成金刚石是吸热反应
石墨转变成金刚石是吸热反应
B. 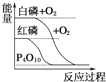 白磷比红磷稳定
白磷比红磷稳定
C. 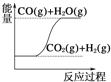 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
D. 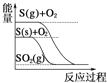 S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4·7H2O。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)

部分阳离子以氢氧化物形式沉淀时的pH如表:

(1)溶液①中的阴离子有_________,“酸浸”时所加入的酸是____________(填化学式)。
(2)加入H2O2时发生反应的离子方程式为________________________,操作b为调节溶液的pH,你认为pH的调控范围是___________________。
(3)产品晶体中混有少量绿矾(FeSO4·7H2O),其原因可能是_______________(写出一点即可)。
称取50克该产品晶体配成100mL溶液,取20mL该溶液用0.1mol/L的酸性KMnO4溶液滴定,消耗酸性KMnO4溶液10mL(Ni2+不被氧化),则该产品晶体的纯度是___________。
(4)NiSO4·7H2O可用于制备镍氢电池(NiMH),NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中正极电极反应式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com