
 �����£���25mL 0.1mol/LMOH��Һ����μ���0.2mol/L HA��Һ��������ͼ��ʾ�������Ϻ���Һ�����С�仯���Բ��ƣ����ش��������⣺
�����£���25mL 0.1mol/LMOH��Һ����μ���0.2mol/L HA��Һ��������ͼ��ʾ�������Ϻ���Һ�����С�仯���Բ��ƣ����ش��������⣺| Kw |
| K |
| c(HA)?c(OH-) |
| c(A-)?c(H+) |
| ||
|
| 2 |
| 5 |
| Kw |
| K |
| 10-13 | ||
|


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�48gO3���е���ԭ����ΪNA�� |
| B��24g����þ��Ϊþ����ʱʧȥ�ĵ�����ΪNA�� |
| C����0�桢101kPʱ��28gN2��CO�Ļ�����壬�����ԼΪ22.4L |
| D��ͬ��ͬѹ�£�NA��NO��NA��N2��O2�Ļ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������������Һ��Ӧ |
| B��������þ�����ᷴӦ |
| C������ʯ��ˮ�����ᷴӦ |
| D������������ϡ���ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
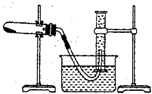
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
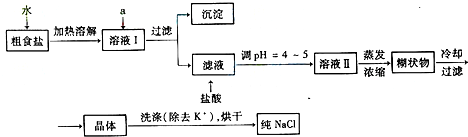
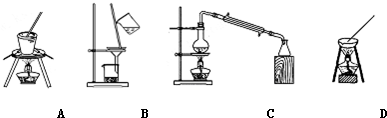
| ��ѧʽ | CaCO3 | CaSO4 | Ca��OH��2 | MgCO3 | Mg��OH��2 |
| Ksp | 2.8��10-9 | 9.1��10-6 | 1.0��10-4 | 3.5��10-5 | 1.6��10-11 |
| 0�� | 10�� | 20�� | 30�� | 40�� | 50�� | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
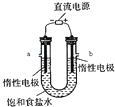
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
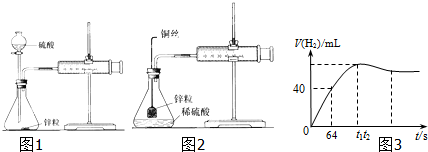
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
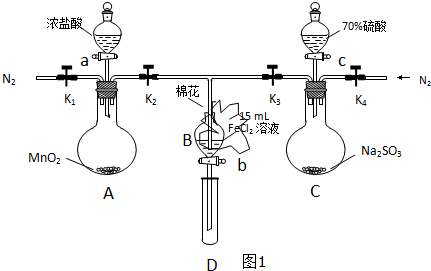
| ���̢�B��Һ�к��е����� | ���̢�B��Һ�к��е����� | |
| �� | ��Fe3+��Fe2+ | ��SO42- |
| �� | ����Fe3+����Fe2+ | ��SO42- |
| �� | ��Fe3+��Fe2+ | ��Fe2+ |
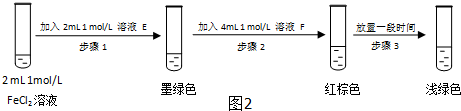
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com