分析:(I)(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌;
(2)ag胆矾中含铜元素质量为ag×
=
a,设能制得氧化铜的质量为X,根据铜守恒由X×
═
a解得X=
a,所以由胆矾制备氧化铜的产率:
×100%=
;
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量即可;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显.
(II)(1)根据n=c×V计算溶质的物质的量,配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,根据m=n×M计算各自质量,配制溶液时注意水的体积不等于溶液的体积;
(2)根据实验步骤进行分析;
(3)根据实验步骤选择仪器;
(4)根据C=
判断浓度的变化.
解答:
解:(I)(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌,所以选择①②③④,故答案为:①②③④;
(2)ag胆矾中含铜元素质量为ag×
=
a,设能制得氧化铜的质量为X,根据铜守恒由X×
═
a解得X=
a,所以由胆矾制备氧化铜的产率:
×100%=
,故答案为:
;
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量,故答案为:cadbe;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显,
故答案为:对比实验,称取相等质量的氯酸钾,加热,比较产生相同体积氧气所需的时间,或比较在相同时间内产生氧气的体积.
(II)(1)配制200mL 1mol?L
-1的CuSO
4溶液,应选用250ml的容量瓶配置250ml,则溶质的物质的量为:n=c×V=0.25L×1mol/L=0.25mol,需要溶质的质量为:m(CuSO
4)=0.25mol×160g/mol=40g,或m(CuSO
4?5H
20)=0.25mol×250g/mol=62.5g.
A、应称取40g无水硫酸铜,配成250mL溶液,故A错误;
B、250mL的容量瓶中配不到200mL溶液,故B错误;
C、应称取40g无水硫酸铜,配成250mL溶液,水的体积不等于溶液的体积,故C错误;
D、称取62.5gCuSO
4?5H
2O,在250mL的容量瓶中配成250mL溶液,故D正确.
故选D;
(2)物质的量浓度思维配置步骤一般为称量、溶解、转移、洗涤、定容、摇匀,故答案为:DAFCBE;
(3)根据实验步骤选用的主要仪器有天平、钥匙、玻璃棒、烧杯、250mL容量瓶、胶头滴管,故答案为:玻璃棒、250mL容量瓶、胶头滴管;
(4)①如果不冷却,则热的溶液转移到容量瓶中,由于热胀冷缩等到室温时体积偏小,根据C=
,浓度偏高,故答案为:偏高;
②洗涤液转入容量瓶后要振荡,若不振荡会使溶液体积偏小,根据C=
,浓度偏高,故答案为:偏高;
③若仰视会使体积偏大,根据C=
,浓度偏低,故答案为:偏低;
④用胶头滴管向容量瓶中加水时,不慎超过刻度线,用胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线,会使溶质变少,根据C=
,浓度偏低,故答案为:偏低;
⑤使用洁净的容量瓶前,瓶中残留有少量蒸馏水,不会产生影响,故答案为:无影响.



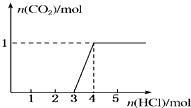 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( ) 常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题: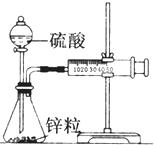 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
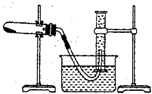
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.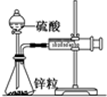 某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )
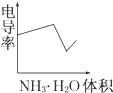
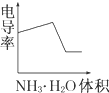
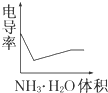
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( ) 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.