
【题目】CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
(1)【提出假设】假设1:沉淀为Cu(OH)2
假设2:沉淀为______________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;

(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设___________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_________(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)B装置使用改进后的试剂,乙同学验证假设3成立的实验现象是A中__________________,B中__________________,C中_________________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是___________(填代号)

A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
E.②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中产生的沉淀的质量为39.4g,A中发生反应的化学方程式为__________ 。
【答案】
(1)CuCO3;(2)1;(3)B;
(4)A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生;
(5)①AC;②2CuCO33Cu(OH)2![]() 5CuO+3H2O↑+2CO2↑.
5CuO+3H2O↑+2CO2↑.
【解析】
试题分析:(1)CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,可能是反应生成了碳酸铜沉淀,或双水解生成了氢氧化铜沉淀,或是碱式碳酸铜,假设1中沉淀为Cu(OH)2,假设2为CuCO3,故答案为:CuCO3;
(2)加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,加热氢氧化铜时生成水蒸气和黑色氧化铜,若反应后A中蓝绿色固体变黑,C中无明显现象证明一定不含有碳酸铜,现象的产生为氢氧化铜,假设1正确,故答案为:1;
(3)实验验证碳酸铜或氢氧化铜是利用受热分解生成的产物性质验证,加热时,碳酸铜分解生成二氧化碳和黑色氧化铜,加热氢氧化铜时生成水蒸气和黑色氧化铜,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分,装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜验证是否生成水,澄清石灰水是否变浑浊证明是否生成二氧化碳,故答案为:B;
(4)装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜,是否变蓝色验证是否生成水,装置C中澄清石灰水是否变浑浊证明是否生成二氧化碳,所以证明假设是否正确的现象为:A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生,故答案为:A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生;
(5)①Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大,故答案为:AC;
②B中吸收的是水,水的物质的量=![]() =0.3mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=
=0.3mol,C中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量=![]() =0.2mol,氧化铜的物质的量=
=0.2mol,氧化铜的物质的量=![]() =0.5mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.5mol:0.6mol:0.2mol=5:6:2,所以其化学式为:2CuCO33Cu(OH)2;CuCO33Cu(OH)2受热分解生成CuO、二氧化碳和水,其反应的方程为:2CuCO33Cu(OH)2
=0.5mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.5mol:0.6mol:0.2mol=5:6:2,所以其化学式为:2CuCO33Cu(OH)2;CuCO33Cu(OH)2受热分解生成CuO、二氧化碳和水,其反应的方程为:2CuCO33Cu(OH)2![]() 5CuO+3H2O↑+2CO2↑;故答案为:2CuCO33Cu(OH)2
5CuO+3H2O↑+2CO2↑;故答案为:2CuCO33Cu(OH)2![]() 5CuO+3H2O↑+2CO2↑.
5CuO+3H2O↑+2CO2↑.


科目:高中化学 来源: 题型:
【题目】下列分散系最不稳定的是( )
A. 向CuSO4溶液中加入NaOH溶液得到的分散系
B. 向水中加入食盐得到的分散系
C. 向沸水中滴入饱和FeCl3溶液得到的红褐色液体
D. 向NaOH溶液中通入CO2得到的无色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是______________。
(2)工作时,正极反应为______________________________。
(3)工作时,电解质溶液的酸性__________(填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向____________极。
(5)电流方向从____________极流向____________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含电子数与 个H2O分子中所含电子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的物质的量是 mol。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 。
(4)标准状况下,①4 g氢气、②33.6 L甲烷(CH4)、③6.02×1023个水分子中,含原子数最多的是_________(填序号)。
(5)在标准状况下,将224L HCl气体溶于635mL(ρ=1.00gcm-3)的水中,所得盐酸的密度为1.20gcm-3。求该盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,不会出现丁达尔效应的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液
⑤FeCl3溶液 ⑥肥皂水
A.④⑤ B.③④
C.②④⑥ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的组成和性质,对纯净物进行分类,然后选择下列合适的物质填在横线上。
O2 Cu H2SO4 Ba(NO3)2 KNO3 CO2 空气 含镁60%的MgO
单质:________;化合物:________;混合物:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活处处有化学。下列说法正确的是
A. 制饭勺、饭盒、高压锅等的不锈钢是合金
B. 做衣服的棉和麻均与淀粉互为同分异构体
C. 煎炸食物的花生油和牛油都是可皂化的饱和酯类
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.Fe3+开始沉淀为氢氧化物的PH=1,沉淀完全时的PH为3.7.
I.某探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:
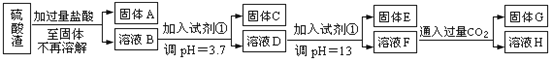
请回答:
(1)写出固体E的化学式:______________.试剂①是__________(填选项字母).
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是__________(填选项字母).
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:______________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
方案二:
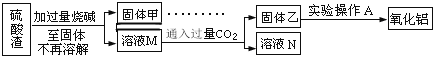
(5)此方案制得的氧化铝含有的主要杂质是_________________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:_______________;_______________。
(7)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:_______________。
(8)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2molL-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com